Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
神長 輝一*; 廣瀬 エリ; 他5名*
Journal of Radiation Research (Internet), 66(3), p.318 - 328, 2025/05
被引用回数:0 パーセンタイル:0.00(Biology)Due to the limited number of accelerator-based X-ray facilities worldwide that provide beams with an adjustable size, their application for radiobiological research purposes has been restricted. Thus, the development of alternative methods is of technical importance for investigating cell/tissue responses in spatially non-uniform radiation fields. In this study, we performed mini beam irradiation of cells using a lead (Pb) sub-milli-collimator as an alternative method to sub-millimeter beams. Also, we employed human cervical carcinoma HeLa cells and hTERT-immortalized fibroblast BJ-1 cells that express fluorescence ubiquitination-based cell-cycle indicators (FUCCI). Time-lapse imaging revealed differences in the behavior of HeLa and BJ-1 cells in spatially heterogeneous radiation fields; in the case of HeLa cells, G2/M phase-arrested cells in the cell population were clearly observed, distinguishing irradiated from non-irradiated cells at the sub-millimeter scale level. Our findings indicate that FUCCI can be useful as a biological dose indicator, depending on cell type, and Pb sub-milli-collimators show potential as a possible alternative to accelerator-based X-ray sub-millimeter beams for radiobiological research. The use of the collimators, unlike beamtime experiments in synchrotron facilities with the approval of the committee, is highly versatile and may be beneficial in preliminary studies in a normal laboratory environment.
成田 あゆみ; 神長 輝一; 横谷 明徳; 野口 実穂; 小林 克己*; 宇佐美 徳子*; 藤井 健太郎
Radiation Protection Dosimetry, 166(1-4), p.192 - 196, 2015/09
被引用回数:3 パーセンタイル:23.43(Environmental Sciences)動物培養細胞の細胞周期に依存した放射線照射影響に関する知見は、そのほとんどが照射された細胞集団を統計学的手法により解析したものである。本研究は、照射された細胞一つを顕微鏡下で直接追跡することにより、刻々と変化する照射細胞の挙動をリアルタイムで観察する手法を確立することを目的とした。照射細胞には細胞周期が判別できるFUCCI(Fluorescent Ubiquitination-based Cell CycleIndicator)発現HeLa細胞(ヒトがん細胞)を用いた。また、照射には細胞一つ分まで大きさが調整できる放射光X線マイクロビームを利用した。さらに照射した細胞を長時間観察するために、細胞を培養しながら観察可能なタイムラプス顕微鏡を立ち上げ、照射した個々の細胞の分裂の様子を追跡した。その結果、G1期で照射した細胞では周期の遅延が認められなかった。それに対してS/G2期にある細胞に照射を行ったところ、明確な周期遅延が観察された。以上から、顕微鏡下での長時間観察によって、放射線照射された細胞への影響をリアルタイムで観察することができた。
神長 輝一; 野口 実穂; 成田 あゆみ; 坂本 由佳; 嘉成 由紀子; 横谷 明徳
Radiation Protection Dosimetry, 166(1-4), p.91 - 94, 2015/09
被引用回数:8 パーセンタイル:52.11(Environmental Sciences)To explore radiation effects on the mammalian cell cycle, it would be essential to trace single cells as live cell images observed by a time-lapse imaging technique. HeLa-FUCCI cells are one of useful model cell lines to visualize cell cycle because their nucleus show different colors. We irradiated the cells with X-rays of 5 Gy. The cells were incubated for 48 hr in a small incubator set on a fluorescent microscope to track about 40 cells. Most of the irradiated cells underwent cell division at M phase, and then progressed into G1 phase. However, about a half of the cell population showed a significantly longer period toward cell division, indicating that G2 phase was prolonged (G2 arrest) by irradiation. The elongation of G2 phase was more prominent for irradiation to cells in S/G2 phase than those in G1 phase. The observed cell cycle modification suggests that G2/M checkpoint system control the cycle to ensure repairing DNA damage.
横谷 明徳; 神長 輝一
放射線生物研究, 49(4), p.418 - 431, 2014/12
最近、細胞標識技術の発展に伴う顕微鏡下でのライブセルイメージングにより、細胞の様々な活動が比較的容易に動画像(ムービー)として観察できるようになった。これらの実験により得られた動画像データは、個々の細胞に関する豊富な情報を含む。このような細胞機能に関するダイナミクスは、従来の免疫染色による静止画像データや細胞集団全体から生化学的に抽出された生体分子の平均化された値からは得ることができない。われわれは、細胞周期がライブセルでモニターできるHeLa-Fucci細胞を試料とし、タイムラプス法を用いてX線照射後に個々の細胞の細胞周期を追跡した。その結果、細胞集団は細胞周期が変調する群とほとんど影響を受けない群の2つに分かれる可能性が示された。このデータに対してシステム生物学的な解釈を試み、HeLa細胞の細胞周期制御とG2/Mチェックポイントのシグナル伝達系に内在する、"デジタル"的なスイッチ機構の存在を推定した。
神長 輝一; 坂本 由佳; 嘉成 由紀子; 野口 実穂; 横谷 明徳
Journal of Radiation Research, 55(Suppl.1), p.i127 - i128, 2014/03
Fluorescent ubiquitination-based cell cycle indicator (FUCCI) HeLa cells are one of useful model cell lines to visualize a cell-cycle because their nuclei show different colors; orange indicating G1; green indicating S/G2. In order to establish a novel assay system to study cell-cycle modification by high LET irradiation such as ion beams for cancer therapy we have observed time-lapse images of HeLa-FUCCI cells irradiated as a preliminary experiment using conventional X-rays instead of high LET ion beams. The cell-cycle was strongly arrested by irradiation at S/G2 and never progressed to G1. In contrast, cells irradiated at G1 progress to S/G2 with a similar time course as non-irradiated control cells. These results show that single FUCCI cell exposure and live cell imaging are a powerful method to trace the single cell effect of high LET irradiation on the cell-cycle in future.
嘉成 由紀子; 野口 実穂; 神長 輝一; 坂本 由佳; 横谷 明徳
Journal of Radiation Research, 55(Suppl.1), p.i129 - i130, 2014/03
In this study, we report a new approach of tracing the mitochondrial morphological change of the cells exposed to high LET radiation using a live-cell imaging technique. We used the NMuMG (Normal murine mammary gland)-FUCCI2 cell line. Using the FUCCI2 expressing cells, we can observe red fluorescence in the nuclei of G1 phase cells and green fluorescence in the nuclei of S/G2/M phase cells. We labeled mitochondria by Mitotracker Red. Kinetics of mitochondrial morphology was analyzed by the live-cell imaging technique using a fluorescence microscope. Mitochondrial images were captured for 4 days after irradiation. In a preliminary study, we found that X-ray irradiation of cells caused mitochondrial fragmentation, and proportion of cell population with fragmented mitochondria increased with increasing dose and with time after irradiation. It is demonstrated that the method proposed in this study works successively to trace cytoplasmic effects by high LET irradiation.
坂本 由佳; 神長 輝一; 嘉成 由紀子; 野口 実穂; 横谷 明徳
Journal of Radiation Research, 55(Suppl.1), p.i120 - i121, 2014/03
In order to examine bystander effects in the 3D cell system, we have developed a FUCCI-HeLa spheroid system. FUCCI (Fluorescent Ubiquitination-based Cell Cycle Indicator) cells show specific colors of cell nuclei depending on a cell cycle. Thus we can easily trace cell cycle modifications by irradiation. We observed bystander cell-cycle delay as preliminary tests using monolayer culture of the HeLa-FUCCI cells. It will be very interesting to examine whether the cell-cycle effect also appears in the 3D cell system exposed to single high LET particles. We have determined suitable conditions for the spheroid culture, such as size of spheroids and methods of stable fixing a spheroid in a dish to perform the microbeam irradiation, and observation of the cell cycles of each cell in a spheroid after irradiation using a time-lapse micro-imaging technique.
坂本 由佳; 嘉成 由紀子; 神長 輝一; 野口 実穂; 横谷 明徳
no journal, ,
低線量放射線による生物影響を考える上で、バイスタンダー効果は1つの重要なポイントであり、これまで様々な報告がされている。しかし、それらの研究のほとんどは単層培養の細胞を使用したものであり、細胞間の情報伝達物質も培地を介して移動することが分かっている。だが、実際の生体内は細胞同士が密になって組織を形成しており、その周囲に培地は存在していない。これらの矛盾を解決すべく、本研究ではスフェロイドに対するX線マイクロビーム照射といった新しい実験系を提案する。本研究ではヒトのガン細胞(HeLa-FUCCI)を培養し、直径100-200ミクロンのスフェロイドを作製した。このスフェロイドの中心に対し、KEK・PFにおいて20ミクロンのX線マイクロビームで部分照射を行った。しかし照射後にスフェロイドの経時観察を行おうとすると、その位置が顕微鏡の視野の外に出てしまうことが分かった。これは培養ディッシュの温度ムラや水蒸気の蒸発による対流が原因と考えられる。スフェロイドが一つだけ入るウェルのあるディッシュなど、さらに工夫が必要であることが分かった。
横谷 明徳; 成田 あゆみ; 神長 輝一; 嘉成 由紀子; 坂本 由佳; 野口 実穂; 宇佐美 徳子*; 小林 克己*; 藤井 健太郎; 鈴木 啓司*
no journal, ,
放射線照射後の細胞をライブイメージング法により追跡して調べることで、これまで細胞集団の平均値としてしか得られなかった放射線影響を個々の細胞の運命として解析するこが可能になった。このような時間軸に対する一連の細胞のダイナミクス(動的)データは、将来のシステムズバイオロジーへの展開・拡張に必須である。本講演では照射による細胞周期の遅延やミトコンドリアの動態を指標として、KEK-PFにおける軟X線マイクロビーム照射した幾つかのFucci細胞に対するライブイメージングにより得た結果を紹介する。さらに、通常の培養ディッシュの単層培養細胞に比べより生体に近い細胞間相互作用を維持していると期待される3次元培養したHeLa-Fucci細胞のスフェロイドを作製し、これに対してマイクロビームを部分照射することでより生体組織に近い環境におけるバイスタンダー効果の観察も試みている。熱力学的には"非平衡状態"にある相互にフィードバックをかけ合う多数のストレス応答の集合として細胞集団システムを捉え、放射線に対する頑強性(ロバストネス)の予測やこれを支える遺伝子スイッチングのメカニズムについての知見が得られると期待される。
神長 輝一; 嘉成 由紀子; 坂本 由佳; 成田 あゆみ; 宇佐美 徳子*; 小林 克己*; 野口 実穂; 横谷 明徳
no journal, ,
放射線の曝露を受けていない細胞(バイスタンダー細胞)が放射線の曝露を受けた細胞からのシグナルを受けることで何らかの影響が発現する現象はバイスタンダー効果と呼ばれ、特に非照射細胞が細胞集団中で多数を占める低線量放射線照射下における影響を考える上で重要なカギとなる。これまでにバイスタンダー細胞に、微小核形成やアポトーシスなどが現れることが知られている。本研究では、バイスタンダー効果が細胞周期に与える影響を明らかにすることを目的とした。コロニー内の任意の細胞に放射光X線マイクロビームを照射した後、全自動タイムラプスイメージングを行える実験系を確立し、細胞分裂を経た細胞にも細胞周期に変異があるかどうかを調べた。その結果、バイスタンダー細胞にも明らかに細胞分裂周期の変異が観測された。非照射細胞が照射細胞からの何らかのシグナルを受け取ることで、自らの細胞周期を制御するための反応経路があることが推定される。
嘉成 由紀子; 神長 輝一; 成田 あゆみ; 宇佐美 徳子*; 鈴木 啓司*; 横谷 明徳
no journal, ,
本研究では、細胞内のエネルギー分子(ATP)生産を担うミトコンドリアの活性が、放射線照射によりどのように影響を受けるかを明らかにすることを目的とした。ヒト正常細胞(BJ1-hTERT)に対して、高エネルギー加速器研究機構フォトンファトリーから得られるX線マイクロビームを照射した後に継時観察し、細胞核のみ・細胞質のみに照射した場合を比較した。細胞は、観察の直前にミトコンドリアを特異的に標識するJC-1試薬で染色した。この試薬はミトコンドリアの膜電位が高いと赤色蛍光のドットとして観測され、また低いと緑色蛍光が観測される特徴がある。その結果、細胞核照射群は細胞質照射群よりも細胞あたりのJC-1赤色発光のドット数が、照射後12時間程度まで優位に増加することが明らかになった。核内で損傷したDNAの修復にATPが用いられるために、活性が亢進したと推測される。
坂本 由佳; 嘉成 由紀子; 神長 輝一; 成田 あゆみ; 野口 実穂; 宇佐美 徳子*; 小林 克己*; 藤井 健太郎; 横谷 明徳
no journal, ,
バイスタンダー効果によるスフェロイド中の非照射部を含めた動態を明らかにすることを目的とし、HeLa-Fucci細胞で作製したスフェロイドに対するX線マイクロビーム照射と、その後の経時観察を行うための新しい実験系を構築した。照射サンプルであるスフェロイドは、照射用ディッシュに移し、アガロースゲルを含んだ培地で周囲を満たして、動かないよう固定した。マイクロビーム照射には、KEK-PF、BL-27B(生物ステーション)の装置を利用した。ビームサイズは40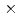 40
40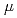 mに設定し、直径150
mに設定し、直径150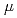 mあるスフェロイドの一部分だけを選択的に狙って照射した。照射後は共焦点レーザー顕微鏡を用いて、細胞周期の変化をライブセル観察した。その結果、マイクロビーム照射部の細胞にのみG2アレストがかかり、細胞周期停止や遅延が起こることが確認された。また、マイクロビームを照射していないスフェロイド、マイクロビームを照射したスフェロイドの非照射部のどちらにも、細胞周期の変化は明確には確認されなかったことから、スフェロイドにおけるバイスタンダー効果は小さいと考えられる。
mあるスフェロイドの一部分だけを選択的に狙って照射した。照射後は共焦点レーザー顕微鏡を用いて、細胞周期の変化をライブセル観察した。その結果、マイクロビーム照射部の細胞にのみG2アレストがかかり、細胞周期停止や遅延が起こることが確認された。また、マイクロビームを照射していないスフェロイド、マイクロビームを照射したスフェロイドの非照射部のどちらにも、細胞周期の変化は明確には確認されなかったことから、スフェロイドにおけるバイスタンダー効果は小さいと考えられる。
神長 輝一; 成田 あゆみ; 野口 実穂; 嘉成 由紀子; 坂本 由佳; 宇佐美 徳子*; 横谷 明徳
no journal, ,
本研究では、細胞周期を可視化したFucci細胞を試料とし、これに対してX線マイクロビーム照射後、タイムラプスイメージング法で自動観察する実験系を確立した。この実験系では、照射細胞とその周囲の非照射細胞の周期を、個別に追跡することができる。DNA損傷や細胞分裂に必要なタンパク質の発現・機能異常がある場合には、細胞周期に変調(遅延や停止)が生じることが知られているため、細胞周期を追跡することで、細胞内のDNA損傷や細胞分裂に必要なタンパク質の発現・機能異常を検出することができる。HeLa.S細胞をFucci化した細胞に対するマイクロビーム照射の結果、非照射細胞に顕著な細胞周期の変調は観察されなかった。HeLa.S細胞はギャップジャンクションが正常に機能していないことが知られている。今回の結果は、バイスタンダー効果によるDNA損傷の誘発や細胞分裂に必要なタンパク質の発現・機能異常には、ギャップジャンクションが大きな役割を果たしていることを示唆している。
神長 輝一; 成田 あゆみ; 野口 実穂; 小林 克己*; 宇佐美 徳子*; 横谷 明徳
no journal, ,
本研究では、放射線の細胞周期への影響を明らかにすることを目指し、X線照射した個々の細胞に対する長時間の経時間観察を行った。対数増殖期にある細胞に放射線を照射すると細胞周期の遅延が観察される。これは、細胞が照射により生じたDNA損傷を修復するための時間を確保するために、チェックポイント機構が働いて細胞周期を一定時間停止させているためであると言われている。本研究では、細胞試料としてFucci化したヒトガン細胞(HeLa)を用いた。Fucci細胞は蛍光顕微鏡下で細胞周期特異的に2色の蛍光(G1期には赤色をG1期以外のS, G2, M期には緑色)を発するため、細胞周期観察には最適な細胞である。照射後の細胞に対して、任意の時間間隔で長時間撮影した(タイムラプスイメージング)。撮影された画像を元に各細胞の周期の長さを測定しところ、5GyのX線を照射したときの細胞周期遅延時間は3.3時間であることがわかった。細胞周期の遅延が観察されたのは、緑色の発現時間が伸びていることから、S, G2あるいはM期のいずれかにおけるチェックポイント機構が働いたためであると考えられる。
坂本 由佳; 嘉成 由紀子; 神長 輝一; 野口 実穂; 横谷 明徳
no journal, ,
細胞に対する低線量放射線による影響を長期にわたって観察するために、福島県から採取してきた土壌を利用した細胞培養装置を立ち上げた。この装置内での線量率は約17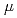 Sv/hであり、現在の飯館村における高線量地区(約5
Sv/hであり、現在の飯館村における高線量地区(約5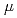 Sv/h)の4倍弱である。この培養装置を用いて30日間にわたりヒトガン細胞(HeLa)の単層培養を行った。30日間の積算線量は13mSvであった。培養した細胞に対して、成長曲線の観測及び急性X線照射による生存率の測定を行った。その結果、成長曲線と生存率の双方において、低線量率照射を行っていない対照群とは明確な差がないことが明らかになった。さらに本研究では、単層培養細胞より生体組織に近い、3次元培養組織(スフェロイド)の作成を試みた。HeLa細胞を試料として用い、さまざまな培養条件を検討した。その結果、低付着性細胞培養器材(24穴)を用い、ひとつの穴(ウェル)あたり1.0
Sv/h)の4倍弱である。この培養装置を用いて30日間にわたりヒトガン細胞(HeLa)の単層培養を行った。30日間の積算線量は13mSvであった。培養した細胞に対して、成長曲線の観測及び急性X線照射による生存率の測定を行った。その結果、成長曲線と生存率の双方において、低線量率照射を行っていない対照群とは明確な差がないことが明らかになった。さらに本研究では、単層培養細胞より生体組織に近い、3次元培養組織(スフェロイド)の作成を試みた。HeLa細胞を試料として用い、さまざまな培養条件を検討した。その結果、低付着性細胞培養器材(24穴)を用い、ひとつの穴(ウェル)あたり1.0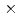 10
10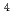 以上の細胞数を播種し、これを4日間培養することが最適条件であることを見いだした。今後この条件で作成したスフェロイドに対して、低線量照射実験を行う予定である。
以上の細胞数を播種し、これを4日間培養することが最適条件であることを見いだした。今後この条件で作成したスフェロイドに対して、低線量照射実験を行う予定である。
神長 輝一; 成田 あゆみ; 野口 実穂; 嘉成 由紀子; 坂本 由佳; 横谷 明徳
no journal, ,
本研究では、放射線が照射された細胞の周期がどのような影響を受けるかを明らかにすることを目的とした。細胞周期特異的に核が蛍光を発するように設計されたFucci化したヒト細胞を照射試料として用いて、個々の細胞を追跡しながら観察を行った。観察には、小型インキュベーターを内蔵した蛍光顕微鏡を用いた。細胞にX線を照射したのち、48時間のタイムラプス観察を行った。得られた画像データから個々の細胞の細胞周期を特定しコントロール細胞の細胞周期と比較することでX線照射による細胞周期変化を分析した。X線を5Gy照射した場合に観察される細胞周期変化は、約3.3時間の遅延であった。さらに照射細胞周囲の非照射細胞への影響を調べるため、培養ディシュの半分にのみX線(20Gy)を照射したところ、非照射細胞にも明らかな細胞周期の遅延が観察された。これまでにも照射細胞から非照射細胞へ信号が伝達され、微小核形成などの影響が現れる所謂バイスタンダー効果が知られてきた。本研究により、細胞周期遅延誘発にもバイスタンダー効果があることが初めて示された。
神長 輝一; 嘉成 由紀子; 坂本 由佳; 成田 あゆみ; 宇佐美 徳子*; 小林 克己*; 野口 実穂; 横谷 明徳
no journal, ,
X線マイクロビームを特定の細胞に狙い撃ちした際に、照射細胞及びその周囲の非照射細胞に生じる細胞分裂の様子の変化を、ライブセルイメージングにより追跡した。X線マイクロビームの照射は、高エネルギー加速器研究機構・フォトンファクトリーのBL27Bの顕微照射システムを利用した。従来の顕微照射システムでは、長時間に渡る細胞の継時観察は困難である。そこで照射顕微ステージとは別に、培養器を備えた観察用顕微システムを導入し、照射細胞の位置座標をこの二つの顕微システム間で校正するため特殊なパターンが印字されたポリエチレンフィルムを製作するなど、タイムラプス細胞観察が行える新たな実験システムを工夫した。細胞周期の遅延や分裂後の娘細胞同士の融合が、照射細胞の周囲の非照射細胞(バイスタンダー細胞)にも伝搬するか否かに着目し、20分間隔で48時間にわたり連続して取得した画像データの解析を行った。その結果、マイクロコロニー中の細胞を一つだけ選んで照射しても、周囲の細胞同士の融合現象は観察されなかった。しかし、アポトーシス等の細胞死は、照射細胞だけではなくある頻度でバイスタンダー細胞にも起る可能性が示された。
神長 輝一; 野口 実穂; 成田 あゆみ; 坂本 由佳; 嘉成 由紀子; 横谷 明徳
no journal, ,
To explore X-irradiation effects on the mammalian cell cycle, we performed to track single cells as live cell images observed by the time-lapse imaging technique. HeLa cells with fluorescent ubiquitination-based cell cycle indicator (FUCCI) were used as irradiation sample cells to visualize cell cycle because their nuclei show different colors. We exposed X-rays to the HeLa-Fucci cells and observed them using a fluorescent microscope. We accumulated cells images every 20 min for 48 h and obtained evidences of cell cycle dynamics. The period of G1 and S/G2/(M) phase were analyzed and it was revealed that the irradiated cells were split in two populations, one showing similar cell cycle dynamics with that of unirradiated cells, and another showing modified cell cycle with a prolonged interval before progressing next cell cycle. The heterogeneous mixture of populations of irradiated cells might be involved in finally biological effects such as cell lethality.
野口 実穂; 横谷 明徳; 神長 輝一; 藤井 健太郎; 鈴木 啓司*; 宇佐美 徳子*
no journal, ,
In this study, to clarify activation of autophagy on energy deposition in the cell nucleus or cytoplasm by the photoelectric effect, we investigated change of autophagic activity in human fibroblast cells irradiated with soft X-ray microbeam (5.35keV).Using a synchrotron X-ray microbeam, we irradiated 25 to 61 cells by targeting nuclei with square X-ray microbeam (10 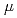 m
m 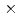 10
10 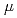 m). For irradiating cytoplasm, 60
m). For irradiating cytoplasm, 60 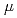 m
m 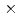 60
60 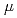 m square X-ray microbeam was used with a metal mask of 10
m square X-ray microbeam was used with a metal mask of 10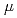 m
m 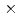 10
10 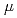 m central area not to irradiate the cell nucleus. Induction of autophagy was measured using the fluorescent probe, Cyto-ID Green, which stains specifically autophagic vacuoles. Irradiated cells were treated with the dye 15 min before observation. The cells observed by a fluorescent microscope were quantified as mean values of the fluorescent intensity per cell. We observed autophagic fluorescence in nucleus- or cytoplasm-irradiated cells at 1 day to 4 days after irradiation. Some of these cells showed highly localized strong fluorescence. Such localized fluorescence was rarely observed when irradiated with a wide beam from a conventional higher energy X-ray machine (150 kVp). A lot of nucleic irradiated cells, rather than cytoplasm-irradiated cell, showed cell death especially at 4 days after irradiation. When irradiated with the wide beam X-rays, on the other hand, the cells sustained irreversible growth arrest, and maintained their viability. These results indicate that the soft X-ray microbeam exposure is a powerful probe to provide us an aspect of autophagic activation by photoelectric (Auger) effect in a particular part of cells.
m central area not to irradiate the cell nucleus. Induction of autophagy was measured using the fluorescent probe, Cyto-ID Green, which stains specifically autophagic vacuoles. Irradiated cells were treated with the dye 15 min before observation. The cells observed by a fluorescent microscope were quantified as mean values of the fluorescent intensity per cell. We observed autophagic fluorescence in nucleus- or cytoplasm-irradiated cells at 1 day to 4 days after irradiation. Some of these cells showed highly localized strong fluorescence. Such localized fluorescence was rarely observed when irradiated with a wide beam from a conventional higher energy X-ray machine (150 kVp). A lot of nucleic irradiated cells, rather than cytoplasm-irradiated cell, showed cell death especially at 4 days after irradiation. When irradiated with the wide beam X-rays, on the other hand, the cells sustained irreversible growth arrest, and maintained their viability. These results indicate that the soft X-ray microbeam exposure is a powerful probe to provide us an aspect of autophagic activation by photoelectric (Auger) effect in a particular part of cells.
神長 輝一; 嘉成 由紀子*; 坂本 由佳*; 野口 実穂; 成田 あゆみ*; 藤井 健太郎; 宇佐美 徳子*; 小林 克己*; 鈴木 啓司*; 横谷 明徳
no journal, ,
We performed selective exposure to HeLa-Fucci cells of a specific cell cycle using synchrotron X-ray microbeam. The results suggested that, not only the irradiated, but also non-irradiated cells surrounding the exposed cells also undergo cell cycle arrest as a consequence of a novel "bystander" effect. When irradiated to spheroids of the HeLa-Fucci cells as a model of 3D cellular tissues, we have succeeded to track the cell cycle modulations in the spheroid using a confocal microscopy. Further we performed sub-cellular irradiation to target a cell nucleus or cytoplasm to look at the effect on mitochondria in human fibroblast cells stained with a specific chemical. Even when the nucleus was irradiated, the potential of mitochondria was enhanced for 12 h. It is inferred that not only DNA damage repair but also certain responses to cellular damage might need excess production of ATP. These clearly show that the live cell imaging appears to be a promising method for single cell tracking.