Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
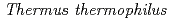 HB8
HB8岡崎 伸生; 安達 基泰; 玉田 太郎; 栗原 和男; 大賀 拓史*; 神谷 信夫*; 倉光 成紀*; 黒木 良太
Acta Crystallographica Section F, 68(1), p.49 - 52, 2012/01
被引用回数:2 パーセンタイル:31.80(Biochemical Research Methods)ADP-ribose pyrophosphatase-I from 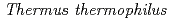 HB8 (
HB8 (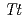 ADPRase-I) prevents the intracellular accumulation of ADP-ribose by hydrolyzing it to AMP and ribose 5'-phosphate. To understand the catalytic mechanism of
ADPRase-I) prevents the intracellular accumulation of ADP-ribose by hydrolyzing it to AMP and ribose 5'-phosphate. To understand the catalytic mechanism of 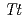 ADPRase-I, it is necessary to investigate the role of glutamates and metal ions as well as the coordination of water molecules located at the active site. A macroseeding method was developed in order to obtain a large
ADPRase-I, it is necessary to investigate the role of glutamates and metal ions as well as the coordination of water molecules located at the active site. A macroseeding method was developed in order to obtain a large 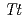 ADPRase-I crystal which was suitable for a neutron diffraction study to provide structural information. Neutron and X-ray diffraction experiments were performed at room temperature using the same crystal. The crystal diffracted to 2.1 and 1.5
ADPRase-I crystal which was suitable for a neutron diffraction study to provide structural information. Neutron and X-ray diffraction experiments were performed at room temperature using the same crystal. The crystal diffracted to 2.1 and 1.5  resolution in the neutron and X-ray diffraction experiments, respectively. The crystal belonged to the primitive space group
resolution in the neutron and X-ray diffraction experiments, respectively. The crystal belonged to the primitive space group  3
3 21, with unit-cell parameters
21, with unit-cell parameters 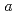 =
= 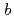 = 50.7,
= 50.7, 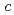 = 119
= 119  .
.
安達 基泰; 玉田 太郎; 栗原 和男; 大賀 拓史*; 倉光 成紀*; 黒木 良太
no journal, ,
ADPリボースピロフォスファターゼ(ADPRase)は、ADPリボースをリボース5'リン酸とAMPに加水分解する酵素である。本研究では、中性子結晶構造解析によって、ADPRaseの触媒反応に関与する水分子の役割や解離性アミノ酸のイオン化状態を明らかにし、触媒機構を詳細に解明することを目的としている。大腸菌を用いて組換え型ADPRaseを調製後、マクロシーディング法によって3.2 2.8
2.8 1.5(13mm
1.5(13mm )の結晶を取得した。得られた結晶を20日間重水素化溶液中でソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で2.1オングストロームの回折データが得られた。さらに、ADPRaseの完全重水素化の取り組みについても報告する。
)の結晶を取得した。得られた結晶を20日間重水素化溶液中でソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で2.1オングストロームの回折データが得られた。さらに、ADPRaseの完全重水素化の取り組みについても報告する。
安達 基泰; 黒木 良太; 倉光 成紀*; 大賀 拓史*
no journal, ,
ADPRase(ADP-リボース ピロホスファターゼ)は、ADP-リボースをリボース 5'リン酸とAMPに加水分解する酵素で、毒性のあるヌクレオチド2リン酸類の解毒作用などを担っていると考えられている。ADPRaseの結晶構造解析は、X線によって行われているが、水素原子を含めた酵素の加水分解メカニズムは、明らかでない。そこで、本研究では、ADPRaseの中性子結晶構造解析を行うことで、ADPRaseの加水分解メカニズムの詳細を明らかにすることを目的としている。本発表では、緒言,超好熱菌ADPRaseの結晶の中性子を使った予備的データ測定,大型結晶の作成,重水素化タンパク質の調製について報告する。
安達 基泰; 玉田 太郎; 栗原 和男; 大賀 拓史*; 倉光 成紀*; 黒木 良太
no journal, ,
ADPリボースピロフォスファターゼ(ADPRase)は、ADPリボースをリボース5'リン酸とAMPに加水分解する酵素である。本研究では、中性子結晶構造解析によって、ADPRaseの触媒反応に関与する水分子の役割や解離性アミノ酸のイオン化状態を明らかにし、触媒機構を詳細に解明することを目的としている。大腸菌を用いて組換え型ADPRaseを調製後、マクロシーディング法によって3.2 2.8
2.8 1.5(13mm
1.5(13mm )の結晶を取得した。得られた結晶を20日間重水素化溶液中にソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で分解能2.1
)の結晶を取得した。得られた結晶を20日間重水素化溶液中にソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で分解能2.1 , R-merge9.7%,完全性73.1%の回折データが得られた。
, R-merge9.7%,完全性73.1%の回折データが得られた。
安達 基泰; 玉田 太郎; 大賀 拓史*; 倉光 成紀*; 黒木 良太
no journal, ,
ADPリボースピロフォスファターゼ(ADPRase)は、ADPリボースをリボース5リン酸とAMPに加水分解する酵素である。本研究では、中性子結晶構造解析によって、ADPRaseの触媒反応に関与する水分子の役割や解離性アミノ酸のイオン化状態を明らかにし、触媒機構を詳細に解明することを目的としている。タンパク質の水素原子を重水素化することにより、中性子回折データのSN比が大きく改善される。大腸菌を用いて完全重水素化組換え型ADPRaseを調製した結果、2リットルの培養液から38mgのタンパク質の調製に成功した。結晶化を実施したところ、0.5 0.3
0.3 0.2mmの大きさの結晶を得ることができた。現在、結晶化条件の最適化を行っている。
0.2mmの大きさの結晶を得ることができた。現在、結晶化条件の最適化を行っている。
岡崎 伸生; 安達 基泰; 大原 高志; 玉田 太郎; 栗原 和男; 大賀 拓史*; 神谷 信夫*; 倉光 成紀*; 黒木 良太
no journal, ,
ADPリボースピロリン酸分解酵素(ADPRase)はNudixファミリーに属し、2価金属イオンの存在下でADPリボース(ADPR)をAMP及びリン酸化リボースに分解する。これにより細胞内に有毒な二リン酸化ヌクレオシド誘導体の蓄積を防ぐ。ADPRaseはADPRに対する高い選択性を持つADPRase-Iと低い選択性のIIに分類され、好熱菌 HB8由来のADPRase-I及び-IIの結晶構造が明らかにされている。報告されているADPRase-IのX線結晶構造において、活性に関与する残基(Glu)のカルボキシル基のプロトン化の状態は明らかではなかった。われわれは上記を含む水素原子の状態を明らかにするため、pD 5.3の環境で
HB8由来のADPRase-I及び-IIの結晶構造が明らかにされている。報告されているADPRase-IのX線結晶構造において、活性に関与する残基(Glu)のカルボキシル基のプロトン化の状態は明らかではなかった。われわれは上記を含む水素原子の状態を明らかにするため、pD 5.3の環境で HB8由来ADPRase-Iの2.5
HB8由来ADPRase-Iの2.5 2.5
2.5 1.5mmの大型結晶を作成、2.1
1.5mmの大型結晶を作成、2.1 分解能の中性子回折データ及び1.5
分解能の中性子回折データ及び1.5 のX線回折データを取得し、joint-refinementにより1122個の水素原子及び479個の重水素原子,112個の水分子を含む立体構造を明らかにした。
のX線回折データを取得し、joint-refinementにより1122個の水素原子及び479個の重水素原子,112個の水分子を含む立体構造を明らかにした。