Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
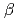 -glucanase from
-glucanase from 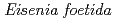
有森 貴夫*; 伊藤 彰紘*; 中澤 昌美*; 上田 光宏*; 玉田 太郎
Journal of Synchrotron Radiation, 20(6), p.884 - 889, 2013/11
被引用回数:18 パーセンタイル:65.16(Instruments & Instrumentation)セルロースを含む木質バイオマスからのバイオエタノール生産における糖化プロセスにおいて、(293K以下でも十分な活性を示す)低温寛容性セルラーゼを用いることができれば、加熱するためのエネルギーを節約できるだけではなく、並行複発酵による高濃度アルコール生産が可能となる。GHファミリー9に属するシマミミズ由来1,4-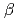 -エンドグルカナーゼ(EF-EG2)は313Kにおいて最大活性を示すが、283Kにおいても比較的高い活性を保持する。酵母を用いた組換え型EF-EG2の発現系を構築し、引き続き試料精製および結晶化を実施したところ、回折実験可能な針状結晶を得ることに成功した。この結晶を用いて放射光施設において1.5
-エンドグルカナーゼ(EF-EG2)は313Kにおいて最大活性を示すが、283Kにおいても比較的高い活性を保持する。酵母を用いた組換え型EF-EG2の発現系を構築し、引き続き試料精製および結晶化を実施したところ、回折実験可能な針状結晶を得ることに成功した。この結晶を用いて放射光施設において1.5 分解能の回折データを収集し、結晶学的
分解能の回折データを収集し、結晶学的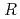 値が14.7%(free-
値が14.7%(free-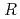 値が16.8%)まで精密化を完了した。EF-EG2の全体構造は(
値が16.8%)まで精密化を完了した。EF-EG2の全体構造は( /
/ )
)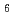 バレルから成り、その中心に活性部位と想定されるクレフトが確認された。また、分子表面は負電荷に富んでいたが、この特徴は構造既知の低温寛容性酵素においても広く観察されており、EF-EG2の低温寛容性との関連が示唆された。
バレルから成り、その中心に活性部位と想定されるクレフトが確認された。また、分子表面は負電荷に富んでいたが、この特徴は構造既知の低温寛容性酵素においても広く観察されており、EF-EG2の低温寛容性との関連が示唆された。
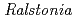 sp. A-471 reveals a unique arrangement of the catalytic residues for inverting chitin hydrolysis
sp. A-471 reveals a unique arrangement of the catalytic residues for inverting chitin hydrolysis有森 貴夫*; 川本 乃理子*; 新家 粧子*; 岡崎 伸生*; 中澤 昌美*; 宮武 和孝*; 深溝 慶*; 上田 光宏*; 玉田 太郎
Journal of Biological Chemistry, 288(26), p.18696 - 18706, 2013/07
被引用回数:31 パーセンタイル:62.77(Biochemistry & Molecular Biology)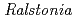 sp. A-471由来のキチナーゼC(Ra-ChiC)の活性ドメインはG型リゾチームと類似した配列を有し、他のキチナーゼとは異なりGHファミリー23に属する。しかしながら、NMRを用いた解析ではRa-ChiCはキチン二量体と相互作用する一方で、ペプチドグリカン断片とは相互作用しなかった。本論文では、Ra-ChiCの活性ドメイン(野生型, E141Q, E162Q変異体)及びキチンオリゴ糖複合体の結晶構造解析を報告する。Ra-ChiCは基質特異性をつかさどるトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、他のGH23型酵素や反転型GH19キチナーゼとは異なっており、Ra-ChiCの特徴的な機能と関連していると考えられた。
sp. A-471由来のキチナーゼC(Ra-ChiC)の活性ドメインはG型リゾチームと類似した配列を有し、他のキチナーゼとは異なりGHファミリー23に属する。しかしながら、NMRを用いた解析ではRa-ChiCはキチン二量体と相互作用する一方で、ペプチドグリカン断片とは相互作用しなかった。本論文では、Ra-ChiCの活性ドメイン(野生型, E141Q, E162Q変異体)及びキチンオリゴ糖複合体の結晶構造解析を報告する。Ra-ChiCは基質特異性をつかさどるトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、他のGH23型酵素や反転型GH19キチナーゼとは異なっており、Ra-ChiCの特徴的な機能と関連していると考えられた。
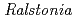 sp. A-471
sp. A-471岡崎 伸生; 有森 貴夫; 中澤 昌美*; 宮武 和孝*; 上田 光宏*; 玉田 太郎
Acta Crystallographica Section F, 67(4), p.494 - 497, 2011/04
被引用回数:3 パーセンタイル:40.30(Biochemical Research Methods)Chitinase from the moderately thermophilic bacterium 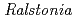 sp. A-471 (Ra-ChiC) is divided into two domains: a chitin-binding domain (residues 36-80) and a catalytic domain (residues 103-252). Although the catalytic domain of Ra-ChiC has homology to goose-type lysozyme, Ra-ChiC does not show lysozyme activity but does show chitinase activity. The catalytic domain with part of an interdomain loop (Ra-ChiC
sp. A-471 (Ra-ChiC) is divided into two domains: a chitin-binding domain (residues 36-80) and a catalytic domain (residues 103-252). Although the catalytic domain of Ra-ChiC has homology to goose-type lysozyme, Ra-ChiC does not show lysozyme activity but does show chitinase activity. The catalytic domain with part of an interdomain loop (Ra-ChiC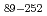 ) was crystallized under several different conditions using polyethylene glycol as a precipitant. The crystals diffracted to 1.85
) was crystallized under several different conditions using polyethylene glycol as a precipitant. The crystals diffracted to 1.85 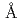 resolution and belonged to space group
resolution and belonged to space group 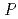 6
6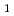 22 or
22 or 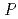 6
6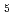 22, with unit-cell parameters
22, with unit-cell parameters 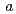 =
= 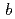 = 100,
= 100, 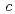 = 243
= 243 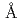 . The calculated Matthews coefficient was approximately 3.2, 2.4 or 1.9
. The calculated Matthews coefficient was approximately 3.2, 2.4 or 1.9 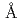
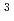 Da
Da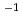 assuming the presence of three, four or five Ra-ChiC
assuming the presence of three, four or five Ra-ChiC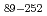 molecules in the asymmetric unit, respectively.
molecules in the asymmetric unit, respectively.
有森 貴夫; 川本 乃理子*; 岡崎 伸生; 中澤 昌美*; 宮武 和孝*; 上田 光宏*; 玉田 太郎
no journal, ,
好熱性細菌由来キチナーゼ(Ra-ChiC)は、天然資源であるキチンをさまざまな分野で利用できるオリゴ糖へと分解する。しかしRa-ChiCはこれまでに同定されているキチナーゼとはアミノ酸配列の相同性を有さず、キチナーゼとしては唯一GH family 23に分類される。一方、GH family 23にはおもにガチョウ型(G-type)リゾチームが属しているが、Ra-ChiCはリゾチーム活性を有さない。われわれは、Ra-ChiCの基質認識機構及び触媒反応機構を解明するため、触媒ドメインのリガンド非結合型及びキチンオリゴ2糖結合型の結晶構造解析を行った。Ra-ChiCの活性部位の構造から、われわれはRa-ChiCの触媒反応にはG-typeリゾチームにも保存されているE141だけでなく、G-typeリゾチームには保存されていないD226も寄与すると予想した。そこで変異体実験を実施した結果、どちらの残基においても変異体では著しい活性の低下が見られた。さらに、E141Q変異体とキチンオリゴ4糖との複合体についても結晶構造を決定した。この構造をもとにリゾチームの基質の構成要素であるN-アセチルムラミン酸(NAM)の結合モデルを作成したところ、Ra-ChiCではD226が存在するループ領域が活性部位を覆っているため、G-typeリゾチームより基質結合部位が狭く、かさ高い置換基を持つNAMの結合においては立体障害が生じることがわかった。このことから、Ra-ChiCがリゾチーム活性を示さないのは、このような基質結合部位の構造の違いが原因であると考えられた。
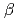 -glucanase from Eisenia foetida
-glucanase from Eisenia foetida有森 貴夫*; 伊藤 彰紘*; 中澤 昌美*; 上田 光宏*; 玉田 太郎
no journal, ,
We cloned the gene for endo-1,4-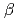 -glucanase from Eisenia foetida (EF-EG2) consisting of 1368 bp encoding 456 amino acid residues. The amino acid sequence of the gene shares sequence homology (
-glucanase from Eisenia foetida (EF-EG2) consisting of 1368 bp encoding 456 amino acid residues. The amino acid sequence of the gene shares sequence homology (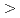 50%) with endo-1,4-
50%) with endo-1,4-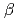 -glucanases belonging to glycoside hydrolase family 9. The recombinant EF-EG2 showed highest activity at 40
-glucanases belonging to glycoside hydrolase family 9. The recombinant EF-EG2 showed highest activity at 40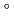 C, and also retained a comparatively high activity at 10
C, and also retained a comparatively high activity at 10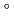 C. We purified the recombinant EF-EG2 expressed in Pichia pastoris, and then grew needle shaped EF-EG2 crystals with dimensions of 0.02
C. We purified the recombinant EF-EG2 expressed in Pichia pastoris, and then grew needle shaped EF-EG2 crystals with dimensions of 0.02  0.02
0.02 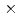 1 mm. Diffraction data of EF-EG2 was collected at beamline 1A, Photon Factory, KEK, and integrated and scaled to 2.1
1 mm. Diffraction data of EF-EG2 was collected at beamline 1A, Photon Factory, KEK, and integrated and scaled to 2.1 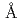 resolution. The crystals belonged to space group
resolution. The crystals belonged to space group 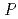 3
3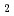 21 with unit-cell parameters of
21 with unit-cell parameters of 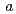 =
= 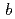 = 135
= 135 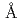 ,
, 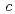 =54.9
=54.9 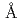 . The location of one EF-EG2 molecule in the asymmetric unit was identified by molecular replacement analysis using the coordinates of endoglucanase from Nasutitermes takasagoensis (NtEgl). The final model of EF-EG2 was refined to a crystallographic
. The location of one EF-EG2 molecule in the asymmetric unit was identified by molecular replacement analysis using the coordinates of endoglucanase from Nasutitermes takasagoensis (NtEgl). The final model of EF-EG2 was refined to a crystallographic 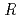 -factor of 17.9% (free R-factor of 21.4%) to 2.1
-factor of 17.9% (free R-factor of 21.4%) to 2.1 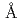 resolution. Overall structure of EF-EG2 is similar to that of NtEgl with an RMSD value of 0.9
resolution. Overall structure of EF-EG2 is similar to that of NtEgl with an RMSD value of 0.9 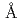 for 423 C
for 423 C atoms, however, a slight difference between both structures was confirmed around substrate binding site.
atoms, however, a slight difference between both structures was confirmed around substrate binding site.
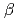 -エンドグルカナーゼの結晶構造解析
-エンドグルカナーゼの結晶構造解析有森 貴夫*; 伊藤 彰紘*; 中澤 昌美*; 上田 光宏*; 玉田 太郎
no journal, ,
植物バイオマスを糖化する際、従来の高温条件下ではなく、低温条件下で効率よく糖化できれば、加温するためのエネルギーを節約することができる。最近われわれは、シマミミズ由来1,4-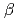 -エンドグルカナーゼ(EF-EG2)のクローニングに成功した。本酵素は、40
-エンドグルカナーゼ(EF-EG2)のクローニングに成功した。本酵素は、40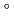 において最大活性を示すが、低温(20
において最大活性を示すが、低温(20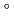 C)条件においても比較的高い活性を保持する。EF-EG2は、456アミノ酸残基から構成される約50kDaの酵素であり、GHファミリー9に属するタカサゴアリ由来の1,4-
C)条件においても比較的高い活性を保持する。EF-EG2は、456アミノ酸残基から構成される約50kDaの酵素であり、GHファミリー9に属するタカサゴアリ由来の1,4-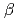 -エンドグルカナーゼ(NTEgl)と高いアミノ酸配列相同性(55%)を有している。われわれは、EF-EG2が低温においても高い活性を保持する機構を立体構造情報から理解することを目的に、EF-EG2の結晶構造解析に取り組んだ。酵母を用いた組換え型酵素の発現系を構築し、引き続き試料精製、結晶化スクリーニング、結晶化条件の最適化を実施した結果、回折実験可能な針状のEF-EG2結晶を得ることに成功した。この結晶を用いて放射光施設において、2.1
-エンドグルカナーゼ(NTEgl)と高いアミノ酸配列相同性(55%)を有している。われわれは、EF-EG2が低温においても高い活性を保持する機構を立体構造情報から理解することを目的に、EF-EG2の結晶構造解析に取り組んだ。酵母を用いた組換え型酵素の発現系を構築し、引き続き試料精製、結晶化スクリーニング、結晶化条件の最適化を実施した結果、回折実験可能な針状のEF-EG2結晶を得ることに成功した。この結晶を用いて放射光施設において、2.1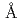 分解能の回折データを収集し、引き続き既知のNTEglの構造情報を用いた分子置換法による位相決定、及び構造精密化を完了した。EF-EG2の全体構造は、一般的なGH9酵素と同様、(
分解能の回折データを収集し、引き続き既知のNTEglの構造情報を用いた分子置換法による位相決定、及び構造精密化を完了した。EF-EG2の全体構造は、一般的なGH9酵素と同様、( /
/ )
)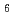 バレル構造をしていたが、糖結合部位付近の構造には他のGH9酵素との構造とわずかな相違がみられた。本発表では、得られたEF-EG2の立体構造と他のGH9酵素の立体構造との詳細比較から、EF-EG2の活性発現及び低温耐性機構について議論したい。
バレル構造をしていたが、糖結合部位付近の構造には他のGH9酵素との構造とわずかな相違がみられた。本発表では、得られたEF-EG2の立体構造と他のGH9酵素の立体構造との詳細比較から、EF-EG2の活性発現及び低温耐性機構について議論したい。
有森 貴夫*; 川本 乃理子*; 岡崎 伸生*; 中澤 昌美*; 宮武 和孝*; 深溝 慶*; 上田 光宏*; 玉田 太郎
no journal, ,
好熱性細菌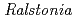 sp. A-471由来キチナーゼ(Ra-ChiC)は、天然資源であるキチンをさまざまな分野で利用できるオリゴ糖へと分解する。しかしRa-ChiCはこれまでに同定されているキチナーゼとはアミノ酸配列の相同性を有さず、キチナーゼとしては唯一GHファミリー23に分類される。一方、GHファミリー23には主にガチョウ型(G-type)リゾチームが属しているが、Ra-ChiCはリゾチーム活性を有さない。われわれは、Ra-ChiCの基質認識機構及び触媒反応機構を解明するため、Ra-ChiCの触媒ドメイン(野生型, E141Q変異体, E162Q変異体)のリガンド非結合型及びキチンオリゴ糖結合型の結晶構造解析を行った。Ra-ChiCは基質特異性を司るトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、Ra-ChiCの特徴的な機能と関連していると考えられた。
sp. A-471由来キチナーゼ(Ra-ChiC)は、天然資源であるキチンをさまざまな分野で利用できるオリゴ糖へと分解する。しかしRa-ChiCはこれまでに同定されているキチナーゼとはアミノ酸配列の相同性を有さず、キチナーゼとしては唯一GHファミリー23に分類される。一方、GHファミリー23には主にガチョウ型(G-type)リゾチームが属しているが、Ra-ChiCはリゾチーム活性を有さない。われわれは、Ra-ChiCの基質認識機構及び触媒反応機構を解明するため、Ra-ChiCの触媒ドメイン(野生型, E141Q変異体, E162Q変異体)のリガンド非結合型及びキチンオリゴ糖結合型の結晶構造解析を行った。Ra-ChiCは基質特異性を司るトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、Ra-ChiCの特徴的な機能と関連していると考えられた。
 sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析
sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析玉田 太郎; 岡崎 伸生; 上田 光宏*; 中澤 昌美*; 宮武 和孝*; 黒木 良太
no journal, ,
好熱性細菌 sp. A-471由来の新規酵素(Ra-ChiC)の1.9
sp. A-471由来の新規酵素(Ra-ChiC)の1.9 分解能での構造解析に成功した。Ra-ChiCの触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
分解能での構造解析に成功した。Ra-ChiCの触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
 sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析
sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析上田 光宏*; 中澤 昌美*; 宮武 和孝*; 岡崎 伸生; 黒木 良太; 玉田 太郎
no journal, ,
好熱性細菌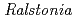 sp. A-471由来の新規酵素(Ra-ChiC)の結晶化スクリーニング及び条件最適化の結果、0.1mm角程度の結晶を取得した。今回の構造解析から、触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
sp. A-471由来の新規酵素(Ra-ChiC)の結晶化スクリーニング及び条件最適化の結果、0.1mm角程度の結晶を取得した。今回の構造解析から、触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
有森 貴夫; 岡崎 伸生; 中澤 昌美*; 宮武 和孝*; 上田 光宏*; 玉田 太郎
no journal, ,
好熱性細菌由来キチン分解酵素Ra-ChiCは、キチン結合ドメインと触媒ドメインから構成されており、その触媒ドメインはガチョウ型リゾチームと18%程度のアミノ酸相同性を有している。しかしながら、Ra-ChiCはキチナーゼ活性のみを示し、リゾチーム活性は示さない。そこでわれわれはRa-ChiCがいかにして有為なキチナーゼ活性を発揮するかを理解することを目的とし、Ra-ChiCの立体構造解析を行った。その結果、ガチョウ型リゾチームの触媒残基であるGlu残基は、Ra-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)が、ガチョウ型リゾチームで活性に関与していると考えられている2つのAsp残基については、Ra-ChiCでは1つは立体的にほぼ似た箇所にGluとして存在し(Glu162)、もう1つは一次構造上全く異なる位置にあるAsp残基が三次構造上で近い位置に存在していた(Asp226)。さらに、Ra-ChiCではAsp226が存在するループ領域が活性部位を覆うような構造をしており、ガチョウ型リゾチームと比較して基質結合ポケットを狭めていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。