好熱性細菌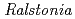 sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析
sp. A-471由来のGH Family 23に属する新規キチナーゼの構造解析
Crystal structure of a novel chitinase, a member of GH family 23, from the moderately thermophilic bacterium 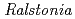 sp. A-471
sp. A-471
上田 光宏*; 中澤 昌美*; 宮武 和孝*; 岡崎 伸生; 黒木 良太; 玉田 太郎
Ueda, Mitsuhiro*; Nakazawa, Masami*; Miyatake, Kazutaka*; Okazaki, Nobuo; Kuroki, Ryota; Tamada, Taro
好熱性細菌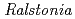 sp. A-471由来の新規酵素(Ra-ChiC)の結晶化スクリーニング及び条件最適化の結果、0.1mm角程度の結晶を取得した。今回の構造解析から、触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
sp. A-471由来の新規酵素(Ra-ChiC)の結晶化スクリーニング及び条件最適化の結果、0.1mm角程度の結晶を取得した。今回の構造解析から、触媒ドメインは7本のへリックスから構成されており、うち5本へリックスについてはガチョウ型リゾチームの立体構造と類似していた。ガチョウ型リゾチームの触媒残基であるグルタミン酸残基はRa-ChiCにおいて側鎖を含め立体的によく保存されていた(Glu141)。ガチョウ型リゾチームで活性に関与していると考えられる2つのアスパラギン酸については、Ra-ChiCにおいて1つは立体的にほぼ似た箇所にグルタミン酸として存在していた(Glu162)のに対し、もう1つは主鎖構造から完全に異なっていた。これらの違いがキチナーゼ活性とリゾチーム活性の違いを創出していると考えられた。
Crystal structure of a novel chitinase (Ra-ChiC), a member of GH family 23, from the moderately thermophilic bacterium 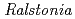 sp. A-471 has been solved in the active site to 1.9
sp. A-471 has been solved in the active site to 1.9  resolution. Crystal structure of Ra-ChiC was resemble to that of g-type lysozyme. It is well known that the residues involved in catalysis of the g-type lysozymes are Glu73, Asp90, and Asp101. The Glu73 (proton donor) in g-type lysozymes was conserved as Glu141 in the catalytic domain of Ra-ChiC.
resolution. Crystal structure of Ra-ChiC was resemble to that of g-type lysozyme. It is well known that the residues involved in catalysis of the g-type lysozymes are Glu73, Asp90, and Asp101. The Glu73 (proton donor) in g-type lysozymes was conserved as Glu141 in the catalytic domain of Ra-ChiC.