Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
有森 貴夫; 山縣 ゆり子*
福岡医学雑誌, 102(11), p.303 - 312, 2011/11
DNAは、さまざまな損傷を受けることが知られており、生物はこれらの損傷に対する多様な防御機構を備えている。DNAの塩基部位の酸化は代表的な損傷の一つである。DNAを構成する塩基の中でも、グアニンは最も酸化損傷を受けやすく、その中でも最も生成されやすい8-オキソグアニン(8oxoG)は、シトシンだけでなくアデニンともミス塩基対を形成してしまうため、DNAのトランスバージョン変異を引き起こす要因となる。ヒトNUDT5は、8oxoGなどを含む多くの酸化損傷ヌクレオチドとADP-リボースをはじめとする複数のADP-sugarを加水分解することから、幅広く細胞内の浄化に寄与している酵素といえる。最近われわれは、NUDT5と酸化ヌクレオチドとの複合体の立体構造解析の結果などから、NUDT5が酵素学的にも大変興味深い非常にユニークな機構によりさまざまな基質を認識し、加水分解していることを明らかにした。本稿では、その立体構造解析の結果を中心に、NUDT5による基質認識機構及び加水分解反応機構を概説する。
有森 貴夫; 玉置 春彦*; 中村 照也*; 紙谷 浩之*; 池水 信二*; 高木 康光*; 石橋 徹*; 原島 秀吉*; 関口 睦夫*; 山縣 ゆり子*
Nucleic Acids Research, 39(20), p.8972 - 8983, 2011/11
被引用回数:26 パーセンタイル:53.25(Biochemistry & Molecular Biology)Human NUDT5 (hNUDT5) hydrolyzes various modified nucleoside diphosphates including 8-oxo-dGDP, 8-oxo-dADP and ADP-ribose (ADPR). However, the structural basis of the broad substrate specificity remains unknown. Here, we report the crystal structures of hNUDT5 complexed with 8-oxo-dGDP and 8-oxo-dADP. These structures reveal an unusually different substrate-binding mode. In particular, the positions of two phosphates ( and
and  phosphates) of substrate in the 8-oxo-dGDP and 8-oxo-dADP complexes are completely inverted compared with those in the previously reported hNUDT5-ADPR complex structure. This result suggests that the nucleophilic substitution sites of the substrates involved in hydrolysis reactions differ despite the similarities in the chemical structures of the substrates and products. To clarify this hypothesis, we employed the isotope-labeling method and revealed that 8-oxo-dGDP is attacked by nucleophilic water at P
phosphates) of substrate in the 8-oxo-dGDP and 8-oxo-dADP complexes are completely inverted compared with those in the previously reported hNUDT5-ADPR complex structure. This result suggests that the nucleophilic substitution sites of the substrates involved in hydrolysis reactions differ despite the similarities in the chemical structures of the substrates and products. To clarify this hypothesis, we employed the isotope-labeling method and revealed that 8-oxo-dGDP is attacked by nucleophilic water at P , whereas ADPR is attacked at P
, whereas ADPR is attacked at P .
.
樋口 真理子; 石田 恒; 北尾 彰朗*; 山縣 ゆり子*; 郷 信広
no journal, ,
放射線や紫外線あるいは細胞内での代謝活動によって生じる活性酸素はヌクレオチドを酸化させる。酸化したヌクレオチドはDNAに取り込まれると突然変異の原因となる。E. Coliから発見された蛋白質MutTは酸化したヌクレオチド8-oxo-dGTPを加水分解し8-oxo-dGMPとすることでDNAに取り込まれることを防いでいる。MutTは8-oxo-dGMPとdGMPを大きな結合力の差(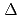
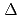 G=6.1kcal/mol)で識別する。しかし、8-oxo-dGMPとdGMPの構造の差は8位の酸素と水素、及び7位の窒素に水素が付加しているか否かでしかない。また、山縣らによりX線結晶構造解析を用いて解かれた8-oxo-dGMP-MutT構造を基質と結合していないMutTの構造と比較すると、おもに基質周りのループ部分が基質を囲むように大きく構造変化していることがわかる。これらのことより、基質によるMutTの構造変化と基質認識に関連があると予想できる。この関連を調べるため、上記の構造をもとに単体のMutT、それぞれの基質との複合体についてAMBER7を用いて分子動力学計算を行い比較した。dGMP-MutTは8oxo-dGMP-MutTの基質をdGMPに入れ替えたものを初期構造とした。その結果、8oxo-dGMP-MutTは基質周りのループが閉じたまま安定で、MutTの構造揺らぎも小さいが、dGMP-MutTでは、MutTの構造が基質と結合していない時の構造に近づき構造揺らぎが大きくなった。また、基質を囲むループが開いたこと、基質結合部位に位置する119Asnの側鎖が回転することにより、基質-MutT間の安定な水素結合の数が減少した。これらはdGMPとMutTの結合時にエントロピー及びエンタルピーの変化が小さいことと定性的に矛盾しない結果である。
G=6.1kcal/mol)で識別する。しかし、8-oxo-dGMPとdGMPの構造の差は8位の酸素と水素、及び7位の窒素に水素が付加しているか否かでしかない。また、山縣らによりX線結晶構造解析を用いて解かれた8-oxo-dGMP-MutT構造を基質と結合していないMutTの構造と比較すると、おもに基質周りのループ部分が基質を囲むように大きく構造変化していることがわかる。これらのことより、基質によるMutTの構造変化と基質認識に関連があると予想できる。この関連を調べるため、上記の構造をもとに単体のMutT、それぞれの基質との複合体についてAMBER7を用いて分子動力学計算を行い比較した。dGMP-MutTは8oxo-dGMP-MutTの基質をdGMPに入れ替えたものを初期構造とした。その結果、8oxo-dGMP-MutTは基質周りのループが閉じたまま安定で、MutTの構造揺らぎも小さいが、dGMP-MutTでは、MutTの構造が基質と結合していない時の構造に近づき構造揺らぎが大きくなった。また、基質を囲むループが開いたこと、基質結合部位に位置する119Asnの側鎖が回転することにより、基質-MutT間の安定な水素結合の数が減少した。これらはdGMPとMutTの結合時にエントロピー及びエンタルピーの変化が小さいことと定性的に矛盾しない結果である。
有森 貴夫; 玉置 春彦*; 中村 照也*; 紙谷 浩之*; 池水 信二*; 高木 康光*; 石橋 徹*; 原島 秀吉*; 関口 睦夫*; 山縣 ゆり子*
no journal, ,
ヒトNUDT5は、変異原性ヌクレオチドとして重要な8-oxo-dGDPをはじめとするさまざまな酸化損傷ヌクレオシド二リン酸を加水分解し、DNAの突然変異の抑制に寄与している一方で、タンパク質の翻訳後修飾に関与するADP-riboseなどのADP-sugarに対しても加水分解活性を示し、幅広く細胞内の浄化に貢献していると考えられている。NUDT5の基質はいずれもヌクレオシド二リン酸を基本骨格としており、触媒反応により二つのリン酸基の間の結合が切断されるが、このピロリン酸部以外の化学構造には多様性があり、NUDT5がいかにしてさまざまな基質を認識し、加水分解するのかは不明であった。そこでわれわれは、X線結晶構造解析と同位体ラベル化法による求核攻撃部位の特定を行い、NUDT5の幅広い基質特異性獲得機構と加水分解反応機構を原子レベルで解明することに成功した。