Growth of large protein crystals by a large-scale hanging-drop method
大規模ハンギングドロップ法による蛋白質の大型結晶成長
垣之内 啓介*; 中村 努*; 玉田 太郎; 安達 宏昭*; 杉山 成*; 丸山 美帆子*; 高橋 義典*; 高野 和文*; 村上 聡*; 井上 豪*; 黒木 良太; 森 勇介*; 松村 浩由*
Kakinouchi, Keisuke*; Nakamura, Tsutomu*; Tamada, Taro; Adachi, Hiroaki*; Sugiyama, Shigeru*; Maruyama, Mihoko*; Takahashi, Yoshinori*; Takano, Kazufumi*; Murakami, Satoshi*; Inoue, Tsuyoshi*; Kuroki, Ryota; Mori, Yusuke*; Matsumura, Hiroyoshi*
本論文は蛋白質の大型結晶成長法について報告である。カットしたピペットチップを用いてハンギング蒸気拡散法による結晶化のための大容量ドロップ(最大で200 l)を作製する。結晶は蒸気-液体界面において成長する。成長した結晶は液-液接触により、マクロシーディングを繰り返し実施することや、キャピラリーへのマウントが可能となる。この大容量ハンギングドロップ蒸気拡散法を用いて、古細菌
l)を作製する。結晶は蒸気-液体界面において成長する。成長した結晶は液-液接触により、マクロシーディングを繰り返し実施することや、キャピラリーへのマウントが可能となる。この大容量ハンギングドロップ蒸気拡散法を用いて、古細菌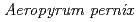 K1由来の抗酸化蛋白質(ApTPx)とニワトリ卵白リゾチームの大型結晶を効率的に産生することが可能となった。この手法により得られたApTPxの大型結晶(6.2mm
K1由来の抗酸化蛋白質(ApTPx)とニワトリ卵白リゾチームの大型結晶を効率的に産生することが可能となった。この手法により得られたApTPxの大型結晶(6.2mm )を用いた中性子回折実験の結果、3.5
)を用いた中性子回折実験の結果、3.5 分解能を上回る回折点を確認できた。
分解能を上回る回折点を確認できた。
A method for growing large protein crystals is described. In this method, a cut pipette tip is used to hang large-scale droplets (maximum volume 200  l) consisting of protein and precipitating agents. A crystal grows at the vapor-liquid interface; thereafter the grown crystal can be retrieved by droplet-droplet contact both for repeated macroseeding and for mounting crystals in a capillary. Crystallization experiments with peroxiredoxin of
l) consisting of protein and precipitating agents. A crystal grows at the vapor-liquid interface; thereafter the grown crystal can be retrieved by droplet-droplet contact both for repeated macroseeding and for mounting crystals in a capillary. Crystallization experiments with peroxiredoxin of 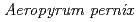 K1(thioredoxin peroxidase, ApTPx) and hen egg white lysozyme demonstrated that this large-scale hanging-drop method could produce a large-volume crystal very effectively. A neutron diffraction experiment confirmed that an ApTPx crystal (6.2 mm
K1(thioredoxin peroxidase, ApTPx) and hen egg white lysozyme demonstrated that this large-scale hanging-drop method could produce a large-volume crystal very effectively. A neutron diffraction experiment confirmed that an ApTPx crystal (6.2 mm ) obtained by this method diffracted to beyond 3.5
) obtained by this method diffracted to beyond 3.5  resolution.
resolution.