Thermodynamic model for the solubility of Ba(SeO , SO
, SO ) precipitates
) precipitates
セレン酸-硫酸バリウム固溶体の溶解度に対する熱力学モデル
Rai, D.*; Felmy, A. R.*; Moore, D. A.*; 北村 暁 
 ; 吉川 英樹; 土井 玲祐
; 吉川 英樹; 土井 玲祐 
 ; 吉田 泰*
; 吉田 泰*
Rai, D.*; Felmy, A. R.*; Moore, D. A.*; Kitamura, Akira; Yoshikawa, Hideki; Doi, Reisuke; Yoshida, Yasushi*
セレン酸バリウムおよび硫酸バリウム混合沈殿物の溶解度について、セレン酸バリウムのモル分率を0.0015 0.3830に変化させ、最長302日間の測定を行った。実験系は65日以内に平衡(安定)状態に到達した。固液各相の活量係数導出にはピッツァーのイオン相互作用モデルを用いた。熱力学解析の結果、実験結果はギブズ-デュエムの式を満足せず、単一の固液の反応がセレン酸および硫酸濃度を支配しているわけではないことがわかった。得られたバリウム,セレン酸および硫酸の各濃度は、セレン酸バリウムの理想固溶体で説明でき、やや結晶性の低い硫酸バリウム固相が硫酸濃度を支配していると説明できる。これらの実験においては、固溶体中の硫酸バリウムの成分は、液相に対して熱力学的な平衡に到達しない。実験値の熱力学解釈では、本研究における実験条件全体にわたって、セレン酸バリウムの理想固溶体とやや結晶性の低い硫酸バリウム固相の両方が互いに平衡状態となっていることが示される。
0.3830に変化させ、最長302日間の測定を行った。実験系は65日以内に平衡(安定)状態に到達した。固液各相の活量係数導出にはピッツァーのイオン相互作用モデルを用いた。熱力学解析の結果、実験結果はギブズ-デュエムの式を満足せず、単一の固液の反応がセレン酸および硫酸濃度を支配しているわけではないことがわかった。得られたバリウム,セレン酸および硫酸の各濃度は、セレン酸バリウムの理想固溶体で説明でき、やや結晶性の低い硫酸バリウム固相が硫酸濃度を支配していると説明できる。これらの実験においては、固溶体中の硫酸バリウムの成分は、液相に対して熱力学的な平衡に到達しない。実験値の熱力学解釈では、本研究における実験条件全体にわたって、セレン酸バリウムの理想固溶体とやや結晶性の低い硫酸バリウム固相の両方が互いに平衡状態となっていることが示される。
The solubility of Ba(SeO , SO
, SO ) precipitates was determined as a function of the BaSeO
) precipitates was determined as a function of the BaSeO mole fractions, ranging from 0.0015 to 0.3830, and time with an equilibration period extending to as long as 302 days. Equilibrium/steady state conditions in this system are reached in
mole fractions, ranging from 0.0015 to 0.3830, and time with an equilibration period extending to as long as 302 days. Equilibrium/steady state conditions in this system are reached in 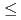 65 days. Pitzer's ion interaction model was used to calculate solid and aqueous phase activity coefficients. Thermodynamic analyses showed that the data do not satisfy Gibbs-Duhem equation, thereby demonstrating that a single-solid solution phase does not control both the selenate and sulfate concentrations. Our extensive data with [Ba], [SeO
65 days. Pitzer's ion interaction model was used to calculate solid and aqueous phase activity coefficients. Thermodynamic analyses showed that the data do not satisfy Gibbs-Duhem equation, thereby demonstrating that a single-solid solution phase does not control both the selenate and sulfate concentrations. Our extensive data with [Ba], [SeO ], and [SO
], and [SO ] can be explained with the formation of an ideal BaSeO
] can be explained with the formation of an ideal BaSeO solid solution phase that controls the selenium concentrations and a slightly disordered/less-crystalline BaSO
solid solution phase that controls the selenium concentrations and a slightly disordered/less-crystalline BaSO (s) that controls the sulfate concentrations. In these experiments the BaSO
(s) that controls the sulfate concentrations. In these experiments the BaSO component of the solid solution phase never reaches thermodynamic equilibrium with the aqueous phase. Thermodynamic interpretations of the data show that both the ideal BaSeO
component of the solid solution phase never reaches thermodynamic equilibrium with the aqueous phase. Thermodynamic interpretations of the data show that both the ideal BaSeO solid solution phase and less-crystalline BaSO
solid solution phase and less-crystalline BaSO (s) phase are in equilibrium with each other in the entire range of BaSeO
(s) phase are in equilibrium with each other in the entire range of BaSeO mole fractions investigated in this study.
mole fractions investigated in this study.