Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
甲斐 健師; 樋川 智洋; 鵜飼 正敏*; 藤井 健太郎*; 渡邊 立子*; 横谷 明徳*
Journal of Chemical Physics, 158(16), p.164103_1 - 164103_8, 2023/04
被引用回数:6 パーセンタイル:69.12(Chemistry, Physical)水の放射線分解・光分解に関する新たな科学的知見は、放射線化学・放射線生物学を含む様々な研究分野の劇的進歩に必要不可欠である。水に放射線を照射すると、その飛跡上に沿って、反応性の高い水和電子が無数に生成される。水和電子は、発生した電子と水分子の運動が動的に相関し、形成されることは知られているが、その形成に至るまでの、電子の非局在化、熱化、分極メカニズムは未だ解明していない。本研究で独自に開発したコードを利用した解析結果から、これらの過渡的現象は、水特有の水素結合ネットワークに由来する分子間振動モードと、水和を進行する水分子の回転モードの時間発展に支配されるように進行することが明らかとなった。本研究によるアプローチは、水に限らず、様々な溶媒に適用可能であり、そこから得られる科学的知見は、放射線生物影響、原子力化学、放射線計測など幅広い研究領域へ適用されることが期待できる。
甲斐 健師; 横谷 明徳*; 藤井 健太郎*; 渡邊 立子*
放射線化学(インターネット), (106), p.21 - 29, 2018/11
放射線によりDNAの数nm以内に複数の損傷部位が生成されると、細胞死や染色体異常のような生物影響が誘発されると考えられている。本稿では、電子線トラックエンドにおいて生成されるDNA損傷が関与する生物影響の誘発について、われわれが進めたシミュレーション研究の成果を解説する。その結果から、1次電子線照射によりDNA鎖切断を含む複数の塩基損傷が1nm以内に密に生成され、その複雑損傷部位から数nm離れた位置に2次電子により塩基損傷が誘発されることが示された。この孤立塩基損傷部位は損傷除去修復が可能であり、結果として鎖切断に変換されるため、1次電子線により生成された鎖切断と合わせ、最終的にDNAの2本鎖切断が生成され得る。この2本鎖切断末端は塩基損傷を含むために修復効率が低下し、未修復・誤修復により染色体異常のような生物影響が誘発されることが推測された。本シミュレーション研究の成果はDNA損傷の推定のみならず放射線物理化学過程が関与する現象の解明にも有益となる。
甲斐 健師; 横谷 明徳*; 鵜飼 正敏*; 藤井 健太郎*; 樋川 智洋; 渡邊 立子*
Physical Chemistry Chemical Physics, 20(4), p.2838 - 2844, 2018/01
被引用回数:27 パーセンタイル:77.81(Chemistry, Physical)放射線生物影響を誘発する複雑DNA損傷はエネルギー付与率の高い放射線トラックエンドで生成されやすいと考えられている。そのDNA損傷を推定するために、電子線トラックエンドにおける水の放射線分解最初期過程について、計算シミュレーションに基づいた理論的研究を実施した結果から、1次電子線照射によりDNA鎖切断を含む複数の塩基損傷が1nm以内に密に生成され得ることが示された。この複雑DNA損傷は損傷除去修復が困難である。更に、その複雑損傷部位から数nm離れた位置に2次電子により塩基損傷が誘発されることが示された。この孤立塩基損傷部位は損傷除去修復が可能であり、結果として鎖切断に変換されるため、1次電子線により生成された鎖切断と合わせ、最終的にDNAの2本鎖切断が生成され得る。この2本鎖切断末端は塩基損傷を含むために修復効率が低下し、未修復・誤修復により染色体異常のような生物影響が誘発されることが推測された。
渡邊 立子*; 甲斐 健師; 服部 佑哉*
Radioisotopes, 66(11), p.525 - 530, 2017/11
放射線による生物影響のメカニズムの解明には、モデルやシミュレーションを用いた研究は重要な役割を持つ。特に、生物影響メカニズムに関するモデル化や、DNA分子と細胞のような生体の異なる空間スケールから得られた実験データの関係を評価するためにはミュレーションは有効な手段である。本稿では、DNAと細胞への放射線影響のシミュレーションによる研究の概要について述べる。この中で、従来のDNA損傷推定法に加えDNA損傷生成に関わる物理化学過程の詳細を推定する新たな理論的アプローチと、DNA損傷と細胞応答のダイナミクスを推定する数理モデルも紹介する。
甲斐 健師; 横谷 明徳*; 藤井 健太郎*; 渡邊 立子*
陽電子科学, (8), p.11 - 17, 2017/03
放射線により、DNAの数nm以内に複数の損傷部位が生成されると、細胞死や染色体異常のような生物影響が誘発されると考えられている。著者らは、DNA損傷生成の機構に関係すると考えられる細胞内の放射線作用の解析として、細胞と組成の近い水中で高エネルギーの1次電子線・陽電子線により生成される2次電子の動的挙動を計算した。その結果、2次電子は、親イオン近傍で電離・電子的励起を誘発しやすく、減速した電子の約10%は、クーロン引力により親イオン付近に分布することが分かった。続いて、これらの計算結果から、以下のように複雑なDNA損傷の生成機構を推定した。DNA内部から電離した2次電子は、DNA外部に飛び出す前に、DNA内部で電離・電子的励起を誘発可能である。さらに、クーロン力により引き戻された電子は、DNAの水和層で水和前電子になり、解離性電子移行によりDNA損傷を誘発可能である。結果として、1次電子線・陽電子線のみならず2次電子の作用により、1nm以内に複雑DNA損傷が生成され得る。
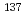 Cs
Cs渡辺 立子; 服部 佑哉; 甲斐 健師
International Journal of Radiation Biology, 92(11), p.660 - 664, 2016/11
被引用回数:3 パーセンタイル:25.53(Biology)本研究では、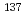 Csによる内部照射の担い手となるオージェ電子や内部転換電子等の低エネルギー電子のエネルギースペクトルや電子の放出位置の違いが、DNAレベルの微小な標的における線量分布とDNA損傷に与える影響を明らかにするために、電子線のトラックの微視的なシミュレーションに基づいた、線量分布とDNA損傷スペクトル(量や質)の推定を行った。方法としては、細胞集団モデルを標的系として、微視的なトラックシミュレーションを行い、次に、DNA損傷生成モデルに基づいた損傷スペクトルを計算した。計算結果を解析したところ、オージェ電子線等によるDNA損傷のスペクトルには、外部照射(
Csによる内部照射の担い手となるオージェ電子や内部転換電子等の低エネルギー電子のエネルギースペクトルや電子の放出位置の違いが、DNAレベルの微小な標的における線量分布とDNA損傷に与える影響を明らかにするために、電子線のトラックの微視的なシミュレーションに基づいた、線量分布とDNA損傷スペクトル(量や質)の推定を行った。方法としては、細胞集団モデルを標的系として、微視的なトラックシミュレーションを行い、次に、DNA損傷生成モデルに基づいた損傷スペクトルを計算した。計算結果を解析したところ、オージェ電子線等によるDNA損傷のスペクトルには、外部照射( 線照射)の場合と比べて大きな差が生じないことが示され、内部照射は外部照射と比べてDNA損傷が起きやすいということはないという結果が得られた。
線照射)の場合と比べて大きな差が生じないことが示され、内部照射は外部照射と比べてDNA損傷が起きやすいということはないという結果が得られた。
甲斐 健師; 横谷 明徳; 鵜飼 正敏; 藤井 健太郎; 渡辺 立子
International Journal of Radiation Biology, 92(11), p.654 - 659, 2016/11
被引用回数:13 パーセンタイル:72.77(Biology)We performed a fundamental study of deceleration of low-energy electron ejected from water to predict clustered DNA damage formation involved in the decelerating electrons in water using a dynamic Monte Carlo code included Coulombic force between ejected electron and its parent cation. The decelerating electron in water was recaptured by the Coulombic force within hundreds of femtosecond. We suggested that the return electron contribute to modification of DNA damage because the electron will recombine to electric excited states of the parent cation, or will be prehydrated in water layer near the parent cation in DNA. Thus effect of the Coulombic force plays a significant role in evaluation of DNA damage involved in the electron deceleration in water.
甲斐 健師; 横谷 明徳*; 鵜飼 正敏*; 藤井 健太郎*; 渡邊 立子*
Journal of Physical Chemistry A, 120(42), p.8228 - 8233, 2016/10
被引用回数:24 パーセンタイル:69.27(Chemistry, Physical)放射線照射により細胞中で生成された低エネルギー2次電子は、生物影響を誘発する複雑なDNA損傷生成に関与すると考えられている。本研究では、DNA損傷の推定を行うために、水中における低エネルギー2次電子の動力学的挙動の数値計算による理論的研究を実施した。計算結果から、水中で減速した電子は、親イオンのクーロン場に徐々に引きつけられ、数百fs程度になると親イオンから半径2nm以内の領域に12.6%の電子が分布することが示された。更に、親イオンから半径1nm以内において、電離と電子的励起が主に誘発され、その衝突数は全体の約40%となる。これらの解析結果から、もしDNA内部から低エネルギー2次電子が放出されると、複雑なDNA損傷が、電離や電子的励起に加え、解離性電子移行により生成され得ることを提案した。このような複雑なDNA損傷は、最終的に細胞死や染色体異常のような生物影響の誘発に関与する可能性がある。
甲斐 健師; 横谷 明徳; 藤井 健太郎; 渡辺 立子
放射線化学(インターネット), (101), p.3 - 11, 2016/04
水中における低エネルギー電子の挙動解析は、放射線化学に関する基礎研究や放射線によるDNA損傷の推定の解析等で重要となる。われわれは、これまで低エネルギー2次電子の果たすDNA損傷の役割を解明するため、不確定要素を未だ多く含む放射線物理化学過程の研究を進めてきた。また、これらの研究成果に基づき、DNA内部から電離した2次電子が関与する修復され難いDNA損傷生成過程を新たに理論予測した。本稿は、著者らのこれまでの研究成果について、放射線化学の専門誌で、前・中・後編の3部構成で「放射線物理化学過程に関する最近の進展」と題して解説するものである。前編では、3部にわたって報告する放射線によるDNA損傷研究、放射線物理化学過程研究の現状について、冒頭で概説する。また、トピックスとして、これまでの成果の中から、電子の減速過程を研究する上で必要不可欠となる液相の衝突断面積の計算法に関する研究を紹介し、水中における電子の熱化について、従来予測と異なる点について議論した結果を解説する。
甲斐 健師; 横谷 明徳*; 藤井 健太郎*; 渡邊 立子*
放射線化学(インターネット), (102), p.49 - 56, 2016/00
水中における低エネルギー電子の挙動解析は、放射線化学に関する基礎研究や放射線によるDNA損傷の推定の解析等で重要となる。われわれは、これまで低エネルギー2次電子の果たすDNA損傷の役割を解明するため、不確定要素を未だ多く含む放射線物理化学過程の研究を進めてきた。また、これらの研究成果に基づき、DNA内部から電離した2次電子が関与する修復され難いDNA損傷生成過程を新たに理論予測した。本稿は、われわれのこれまでの研究成果について、放射線化学の専門誌で、前・中・後編の3部構成で「放射線物理化学過程に関する最近の進展」と題して解説するものである。中編では、本研究において開発した動力学モンテカルロコードを検証するために、電子の熱化距離や熱化時間に関する計算結果を紹介し、熱化と水和前過程について、これまでの従来予測と異なる点について議論した成果を解説する。
服部 佑哉; 横谷 明徳; 渡辺 立子
BMC Systems Biology (Internet), 9, p.90_1 - 90_22, 2015/12
被引用回数:17 パーセンタイル:63.19(Mathematical & Computational Biology)低線量放射線が照射された細胞集団では、細胞間シグナル伝達により、放射線が当たっていない細胞に放射線の影響が伝達する。低線量の放射線による生物影響の評価やリスクを考える上で、個々の細胞間の照射影響伝達が組織や細胞集団に与える影響を調べることは重要である。本研究では、2種類の細胞間シグナル伝達を考慮した細胞集団の放射線応答モデルを構築し、モデルの特性を解析した。モデルは、1細胞レベルで細胞集団の動的変化を表現した数理モデルのセルオートマトンをベースとして、(1)放射線照射、(2)細胞間シグナルの生成と伝達、(3)DNA損傷の誘発、(4)細胞周期変化の要素を新たに導入した。細胞間シグナル伝達では、低線量放射線応答モデルとしては初めて、異なる伝達経路である培養液経由とギャップ結合経由を両方とも考慮した。細胞応答では、細胞周期の時間変化に着目した。モデルの特性解析では、照射線量と細胞間シグナルの伝達経路が、細胞周期変化に与える影響を調べた。解析結果から、細胞周期停止を示す細胞の数が照射線量に対して非線形に増加することが分かった。また、2種類の細胞間シグナル伝達ともに細胞周期停止を誘発し、その細胞数は伝達経路によって異なる時間変化を示した。モデルが示した特性は、今後、実験と比較して検証する。本モデルは、細胞間シグナル伝達による時間・空間的な細胞集団の変化を追跡可能であり、低線量放射線の応答解析に有用である。
甲斐 健師; 横谷 明徳; 鵜飼 正敏*; 藤井 健太郎; 渡辺 立子
Radiation Physics and Chemistry, 115, p.1 - 5, 2015/10
被引用回数:44 パーセンタイル:95.79(Chemistry, Physical)放射線によるDNA損傷において、電子衝突電離により発生した2次電子は難修復性DNA損傷の生成に深く関与すると考えられているが、電子の熱化過程が解明されていないことから、その放射線作用は未だ十分には解明されていない。本研究では、電子の熱化過程の全貌解明のために、水中に照射された電子の熱化距離を、液相の回転・フォノン励起断面積を新たに考慮して計算した。この結果、低エネルギー領域、高エネルギー領域ともに、実験値とよく一致した。しかしながら、熱化時間については従来予測より1桁程度長くなることが分かった。このことから、従来予測に反し、電子の熱平衡化と水和前過程は同時に起こり得ることが推測された。水和前電子は解離性電子移行によりDNA損傷を誘発することから、本研究により推測された水和前過程の生成メカニズムは、2次電子によるDNA損傷の高密度化を推測するために役立つことが期待される。
服部 佑哉; 鈴木 芳代; 舟山 知夫; 小林 泰彦; 横谷 明徳; 渡辺 立子
Radiation Protection Dosimetry, 166(1-4), p.142 - 147, 2015/09
被引用回数:5 パーセンタイル:36.21(Environmental Sciences)本研究では、細胞集団中の細胞間シグナル伝達と細胞周期の時間・空間的な動態を計算可能な数理モデルを構築し、照射する放射線の線量や照射領域によってシグナル伝達がどのように変化するのか、その結果、放射線応答として細胞周期や細胞の生存にどのような変化が現れるのかを明らかにすることを目的とする。提案する放射線応答モデルでは、細胞間のシグナルをギャップ結合経由のシグナルX、培養液経由のシグナルYとし、これら2つのシグナル伝達を誘発する放射線をシグナルZとして表現する。個々の細胞の細胞周期は、周期的な進行(G1, S, G2, M期)がシグナルX, Y, Zによって停止する仮想時計として表現する。講演では、2次元平面上に配置された細胞集団にシグナルZが入力されたとき、シグナルX, Yが拡散方程式に基づいて集団全体に伝達する様子と、各シグナルによって仮想時計(細胞周期)が変化する様子について、線量や照射領域を変えた計算結果の一例を示し、放射線応答の解析に対する本モデルの有用性を報告する。
渡辺 立子; Rahmanian, S.*; Nikjoo, H.*
Radiation Research, 183(5), p.525 - 540, 2015/05
被引用回数:77 パーセンタイル:94.73(Biology)電子線やイオン照射によりDNAに生成する塩基損傷のスペクトルの算出を目的として、モンテカルロトラック構造計算法を用いて、細胞模擬環境中で生じるDNA損傷シミュレーションを行った。鎖切断と塩基損傷からなるDNA損傷ペクトルを、100eV-100keVの電子線と軟X線、数種類のイオン(3.2MeV/u proton、0.74と2.4MeV/u 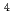 He、29MeV/u
He、29MeV/u 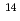 N、950MeV/u
N、950MeV/u 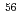 Fe)照射の場合について計算した。計算により見積もられた塩基損傷の生成量は、LETによらずに、一本鎖切断と比べて2-4倍多くなった。また、損傷の空間分布の解析を行った結果、塩基損傷が、鎖切断から成る損傷サイトの複雑化に大きく寄与していることが明らかになった。これらのスペクトルデータは、塩基除去修復によるDNA損傷修復過程のモデル化と損傷修復効率の研究にとって有益なものである。
Fe)照射の場合について計算した。計算により見積もられた塩基損傷の生成量は、LETによらずに、一本鎖切断と比べて2-4倍多くなった。また、損傷の空間分布の解析を行った結果、塩基損傷が、鎖切断から成る損傷サイトの複雑化に大きく寄与していることが明らかになった。これらのスペクトルデータは、塩基除去修復によるDNA損傷修復過程のモデル化と損傷修復効率の研究にとって有益なものである。
甲斐 健師; 横谷 明徳; 鵜飼 正敏*; 渡辺 立子
Radiation Physics and Chemistry, 108, p.13 - 17, 2015/03
被引用回数:31 パーセンタイル:91.42(Chemistry, Physical)放射線によるDNA損傷において、電子衝突電離により発生した2次電子は難修復性DNA損傷の生成に深く関与すると考えられているが、2次電子の放射線作用は未だ十分には解明されていない。その原因の一つとして、電子の熱化過程で主に寄与する液体水の回転・フォノン励起過程の断面積の不備が挙げられる。本研究において、それらの断面積、阻止能及びエネルギー損失率の理論計算を行った結果、液相の回転励起断面積は気相の断面積に比べ3桁以上減少し、フォノン励起断面積は固相の断面積に近い値を示すことが分かった。今日まで1eV以下のエネルギー損失率は電子のエネルギーに強く依存しないと仮定し、電子の熱化過程は評価されてきた。しかしながら、本計算結果から、エネルギー損失率は1eV以下のエネルギーに対して強く依存することが分かった。その結果、電子の熱化時間は従来予測よりも長くなり、後続の水和過程及び化学過程に強く関与する可能性が予測された。本研究成果である回転・フォノン励起断面積は、熱化過程を研究する上で不可欠なデータであり、DNA損傷に対する2次電子の役割を解明するための研究に利用されることが期待される。
津田 修一; 佐藤 達彦; 渡辺 立子; 高田 真志*
Journal of Radiation Research, 56(1), p.197 - 204, 2015/01
被引用回数:2 パーセンタイル:11.21(Biology)重粒子線に対する生物学的効果を実験的に評価するうえで、重粒子線の飛跡及びその近傍における詳細なエネルギー付与分布データは重要となる。本研究では機構で開発し最新の生物学的線量評価モデルに組み込まれているエネルギー付与分布計算モデルの精度検証を行うために、放射線医学総合研究所HIMACにおいて、壁なし型組織等価比例計数管にペンシル状のビームを照射し、径方向の線エネルギー(y)分布データ及びyの線量平均値を得た。ペンシルビームによって生成される信号をビームモニタと比例計数管で同時計測することによって、構造材から発生する二次粒子及びノイズの影響を低減した条件で径方向のy分布データを取得した。yの線量平均値は、ブロードビーム照射と同様に20%以内で計算値と一致した。一方で、PHITSコードのエネルギー付与計算モデルが入射イオンと二次粒子の寄与を独立して表現することに起因して、数100keV/ m以上の高LETイオン入射の場合、同モデルによる結果は実験で得られたy分布を過小評価することがわかった。
m以上の高LETイオン入射の場合、同モデルによる結果は実験で得られたy分布を過小評価することがわかった。
甲斐 健師; 横谷 明徳; 鵜飼 正敏*; 藤井 健太郎; 樋口 真理子; 渡辺 立子
Radiation Physics and Chemistry, 102, p.16 - 22, 2014/09
被引用回数:30 パーセンタイル:88.93(Chemistry, Physical)本研究では水中に入射及び生成された電子のエネルギー緩和過程の詳細に明らかにするために、電子の衝突イベント数及び軌道追跡の時間発展を計算により求めた。本シミュレーション法では電子の軌道を追跡する計算を行うために、分子過程として電子衝突による水分子の電離過程、電子的励起過程、解離性付着過程、振動励起過程、回転励起過程及び弾性散乱過程を考慮し、さらに低エネルギー電子の詳細軌道を計算するために荷電粒子間のクーロン相互作用を考慮した。水中に500eVの電子を入射した際の各分子過程の衝突イベント数を見積もった結果、振動及び回転励起過程をより多発させながらエネルギーを損失することがわかった。また、生成された2次電子は100フェムト秒間で電離した位置から平均3nm程度の位置まで拡散することがわかった。
椎名 卓也*; 渡辺 立子; 鈴木 雅雄*; 横谷 明徳
Journal of Radiation Research, 55(Suppl.1), p.i15 - i16, 2014/03
The object of the study is to reveal whether the induction process of an abasic site (AP site) and the clustered DNA damage which contain AP sites (AP cluster) depends on ionizing density of radiation. In order to clarify the relation between track structure of C ions and the induction processes of an AP site or AP cluster, we measure the yield of AP using Nfo protein as an enzymatic probe, which converts an AP site to detectable single strand break. Several scavenging capacities in the samples are tested to estimate the effect of OH radicals. We compare those experimental yields with theoretical ones that are obtained from Monte Carlo track simulation to develop a model of AP site induction by irradiation. The yields of AP sites analyzed by the simulation are in good agreement with experimental ones. As a result, we newly determined the branching ratio of induction of the AP the site in the simulation.
横谷 明徳; 鵜飼 正敏*; 岡 壽崇*; 甲斐 健師; 渡辺 立子; 藤井 健太郎
しょうとつ, 11(2), p.33 - 39, 2014/03
細胞致死や突然変異などの放射線生物影響の根本原因の一つとされる、DNA分子損傷の局在化の物理メカニズムとその細胞学的影響における役割を明らかにすることが本研究の目的である。これまでに、生体を構成する元素に生じた内殻イオン化と、これに続くAuger過程の物理的な理論及びシミュレーションを行うと同時に、シンクロトロン放射から得られる高輝度の軟X線を用いた分光測定も行い、理論と実験の両面からDNA損傷生成プロセスの探索を行ってきた。特に、内殻イオン化やこれに続く電子の再捕獲などこれまで考慮されていなかった事象を考慮することで、ナノメートル程度の局所に損傷が局在化するクラスターDNA損傷の生成過程に関する知見を得つつある。本論文では、これらの研究の現状を解説する。
 H2AX foci caused by heavy ion particle traversal; Distribution between core track versus non-track damage
H2AX foci caused by heavy ion particle traversal; Distribution between core track versus non-track damage中島 菜花子*; Brunton, H.*; 渡辺 立子; Shrikhande, A.*; 平山 亮一*; 松藤 成弘*; 藤森 亮*; 村上 健*; 岡安 隆一*; Jeggo, P.*; et al.
PLOS ONE (Internet), 8(8), p.e70107_1 - e70107_14, 2013/08
被引用回数:64 パーセンタイル:89.95(Multidisciplinary Sciences)重イオン照射による生物影響のメカニズム研究は、適切な治療計画や線質係数の評価のためには重要である。本研究は、重イオンのトラック内におけるDNA損傷の分布と質を、生物学的及び物理学的見地から解析し、重イオンによるDNA損傷の特徴を理解することを目的とした。このため、鉄イオンをヒトの正常細胞に照射し、DNA2本鎖切断(DSB)のマーカーとなる H2AXフォーカスの分布とイオンのトラック構造の関係を調べた。この結果、トラックの軌跡(コア)に沿ってDSBの多重生成とみなせる巨大なフォーカスが密に、2次電子(デルタ線)に沿って単独のDSBに対応するフォーカスがまばらに形成されることが観測された。これはDSBの分布をトラックシミュレーションにより計算した結果と一致した。また、それぞれのDSBは修復されるが、コアでは細胞周期のチェックポイントにおける停止時間が長くなり、デルタ線タイプの損傷の場合よりも修復に時間を要した。しかし、コアで密にDSBが生じた状態でも細胞周期は進行し、分裂期に入ることができることを確認した。本研究により、トラック構造と対比した形で同一トラック内の損傷の分布と質の違いを明らかにすることができた。
H2AXフォーカスの分布とイオンのトラック構造の関係を調べた。この結果、トラックの軌跡(コア)に沿ってDSBの多重生成とみなせる巨大なフォーカスが密に、2次電子(デルタ線)に沿って単独のDSBに対応するフォーカスがまばらに形成されることが観測された。これはDSBの分布をトラックシミュレーションにより計算した結果と一致した。また、それぞれのDSBは修復されるが、コアでは細胞周期のチェックポイントにおける停止時間が長くなり、デルタ線タイプの損傷の場合よりも修復に時間を要した。しかし、コアで密にDSBが生じた状態でも細胞周期は進行し、分裂期に入ることができることを確認した。本研究により、トラック構造と対比した形で同一トラック内の損傷の分布と質の違いを明らかにすることができた。