Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex
-thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex山田 太郎*; 栗原 和男; 大西 裕季*; 玉田 太郎; 友寄 克亮; 桝見 賢司*; 田中 伊知朗*; 黒木 良太; 新村 信雄*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1834(8), p.1532 - 1538, 2013/08
被引用回数:20 パーセンタイル:52.35(Biochemistry & Molecular Biology) -トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6
-トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6 )/中性子(2.8
)/中性子(2.8 )単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25
)単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25 のX線結晶構造解析により評価した。この複合体は、
のX線結晶構造解析により評価した。この複合体は、 -トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD
-トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD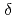 1とD
1とD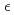 2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO
2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO 周囲には有意な中性子散乱長密度が観察されなかった。また、そのO
周囲には有意な中性子散乱長密度が観察されなかった。また、そのO は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO
は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
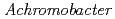 protease I at pD 8.0; Protonation states and hydration structure in the free-form
protease I at pD 8.0; Protonation states and hydration structure in the free-form大西 裕季*; 山田 太郎*; 栗原 和男; 田中 伊知朗*; 崎山 文夫*; 正木 武治*; 新村 信雄*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1834(8), p.1642 - 1647, 2013/08
被引用回数:8 パーセンタイル:22.43(Biochemistry & Molecular Biology)セリンプロテアーゼの鍵となる触媒残基のプロトン化状態を調べるため、pD8.0におけるリガンド非結合型クロモバクタープロテアーゼI(API)の構造を単結晶X線と中性子回折データの同時使用によって精密化した。リガンド非結合型APIの活性部位における触媒三残基の占有率精密化により、H57のイミダゾール環の約30%、S197のヒドロキシル基の約70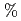 が重水素化されていることが示された。この観察結果は、S197の多くが基質と結合していない状態でもプロトン化されていることを示す。API中の触媒三残基のプロトン化状態をウシ由来
が重水素化されていることが示された。この観察結果は、S197の多くが基質と結合していない状態でもプロトン化されていることを示す。API中の触媒三残基のプロトン化状態をウシ由来 -trypsin-BPTI複合体と比較することにより、基質のS197への近接はS197のヒドロキシル基の酸性を低下し得て、それによってH57はS194のヒドロキシル基から水素を引き抜くことができるという仮説が導かれた。また、APIに特異な残基であるH210は、触媒三残基D113と水素結合を形成していないが、代わりに、H210はS176、H177、一個の水和水と水素結合ネットワークを形成する。大きく疎水性な残基W169が近接することによりこの水素結合ネットワークを保護し、広範囲のpHに渡るAPIの機能を安定化しているかも知れない
-trypsin-BPTI複合体と比較することにより、基質のS197への近接はS197のヒドロキシル基の酸性を低下し得て、それによってH57はS194のヒドロキシル基から水素を引き抜くことができるという仮説が導かれた。また、APIに特異な残基であるH210は、触媒三残基D113と水素結合を形成していないが、代わりに、H210はS176、H177、一個の水和水と水素結合ネットワークを形成する。大きく疎水性な残基W169が近接することによりこの水素結合ネットワークを保護し、広範囲のpHに渡るAPIの機能を安定化しているかも知れない
中川 洋; 上久保 裕生*; 片岡 幹雄
Biochimica et Biophysica Acta; Proteins and Proteomics, 1804(1), p.27 - 33, 2010/01
被引用回数:19 パーセンタイル:45.30(Biochemistry & Molecular Biology)折れ畳まったタンパク質の特性を調べるため、野生型と欠損変異体のスタフィロコッカルヌクレアーゼを用いて非干渉性中性子弾性散乱によりタンパク質の動力学転移に対する構造状態の効果を調べた。変異体はC末端の13残基を欠損させたもので、コンパクトな変性構造を取り、天然変性タンパク質のモデルとされている。非干渉性中性子弾性散乱実験はILLのIN10とIN13で行われた。弾性散乱強度のQ依存性をさまざまな温度で測定し、平均二乗変位を求めた。乾燥タンパク質と水和タンパク質で測定を行った。水和タンパク質では野生型と変異体では差がなかったが、乾燥状態では差が見られた。140Kの転移は乾燥状態と水和状態の両方で見られるが、転移温度前後での平均二乗変位の温度依存性は両者で異なり、折り畳みによる構造のハードニングが見られた。水和によってさらに240Kの転移が生じるが、構造状態には依存しない。これにより水和水のダイナミクスがタンパク質動力学を支配していると言える。
 PprA protein by Atomic force microscopy
PprA protein by Atomic force microscopy村上 正弘*; 鳴海 一成; 佐藤 勝也*; 古川 章*; 早田 勇*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1764(1), p.20 - 23, 2006/01
被引用回数:11 パーセンタイル:23.65(Biochemistry & Molecular Biology)放射線抵抗性細菌デイノコッカス・ラジオデュランスからDNA修復促進タンパク質PprAが単離されたが、その分子機構については未だ詳細に解析されていない。われわれは、DNA修復経路におけるPprAタンパク質の役割を解明するために、直鎖状DNAとPprAタンパク質の相互作用を、固定や染色の操作をせずに原子間力顕微鏡を用いて直接可視化することで解析した。その結果、直鎖状DNAの分子内部と分子末端部へ結合したPprAタンパク質が観察されたが、結合特性の割合を考慮すると、PprAタンパク質は直鎖状DNA分子末端部への結合親和性が高いことがわかった。また、ある条件下において、DNAとPprAタンパク質の環状構造複合体も観察された。さらに、ゲルろ過クロマトグラフィー解析によって、DNAと結合していないPprAタンパク質は、水溶液中で多量体を形成していることが示唆された。