A Structural mechanism for dimeric to tetrameric oligomer conversion in  sp. nucleoside diphosphate kinase
sp. nucleoside diphosphate kinase
 sp.由来ヌクレオシド二リン酸キナーゼにおける二量体-四量体変換の機構の構造学的解明
sp.由来ヌクレオシド二リン酸キナーゼにおける二量体-四量体変換の機構の構造学的解明
新井 栄揮; 米澤 悌; 岡崎 伸生; 松本 富美子; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; Blaber, M.; 徳永 正雄*; 黒木 良太
Arai, Shigeki; Yonezawa, Yasushi; Okazaki, Nobuo; Matsumoto, Fumiko; Tamada, Taro; Tokunaga, Hiroko*; Ishibashi, Matsujiro*; Blaber, M.; Tokunaga, Masao*; Kuroki, Ryota
さまざまな生物種で保存されているヌクレオシドニリン酸キナーゼ(NDK)は、4量体もしくは6量体構造を形成することが知られる。一方、中度好塩菌 sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌
sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌 sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
In order to clarify the oligomer state of nucleoside diphosphate kinase (NDK) from moderately halophilic 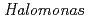 sp. 593 (HaNDK), the crystal structure of HaNDK was determined by X-ray crystallography. The crystal structures of the wild-type HaNDK and the mutant HaNDK (E134A) showed a dimer and a tetramer, respectively. The higher ordered association of proteins usually contributes to an increase in thermal stability and substrate affinity. The change in the assembly form by a minimum mutation may be an effective way for NDK to acquire molecular characteristics suited to various circumstances.
sp. 593 (HaNDK), the crystal structure of HaNDK was determined by X-ray crystallography. The crystal structures of the wild-type HaNDK and the mutant HaNDK (E134A) showed a dimer and a tetramer, respectively. The higher ordered association of proteins usually contributes to an increase in thermal stability and substrate affinity. The change in the assembly form by a minimum mutation may be an effective way for NDK to acquire molecular characteristics suited to various circumstances.