Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
JPS Conference Proceedings (Internet), 8, p.036004_1 - 036004_6, 2015/09
J-PARC/MLFにおいて、250 格子長をもつ長格子蛋白質結晶の中性子回折データの収集を行うため、飛行時間型の高分解能生体高分子用中性子回折計の建設を計画している。我々は、250
格子長をもつ長格子蛋白質結晶の中性子回折データの収集を行うため、飛行時間型の高分解能生体高分子用中性子回折計の建設を計画している。我々は、250 格子長とd
格子長とd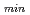 =2.0
=2.0 の反射をターゲットとしたデータ収集を実現するために、適切な線源として非結合型減速材を選択することとした。必要な中性子フラックスおよびパルス幅を考慮し、我々は、減速材、中性子ガイド、サンプルサイズ、中性子検出器を含む単純な装置モデルを考え、ブラッグ反射の分離性能とJ-PARC/MLFでの長格子蛋白質結晶を対象にした新しい回折計設計のための装置パラメータの評価を行った。長格子蛋白質結晶のブラッグ反射分離には、散乱角の増加とともに全飛行距離の延長することが有効である。一方、中角領域(2
の反射をターゲットとしたデータ収集を実現するために、適切な線源として非結合型減速材を選択することとした。必要な中性子フラックスおよびパルス幅を考慮し、我々は、減速材、中性子ガイド、サンプルサイズ、中性子検出器を含む単純な装置モデルを考え、ブラッグ反射の分離性能とJ-PARC/MLFでの長格子蛋白質結晶を対象にした新しい回折計設計のための装置パラメータの評価を行った。長格子蛋白質結晶のブラッグ反射分離には、散乱角の増加とともに全飛行距離の延長することが有効である。一方、中角領域(2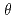
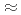 90
90 )での分解可能な検出能を確保するためには、角度発散角を制限することが必要になる。減速材とガイド管の見込む最大角
)での分解可能な検出能を確保するためには、角度発散角を制限することが必要になる。減速材とガイド管の見込む最大角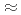 0.2
0.2 の場合、散乱角(2
の場合、散乱角(2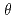
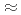 90
90 )から背面バンクの散乱角領域で、格子長250
)から背面バンクの散乱角領域で、格子長250 を超える蛋白質結晶のd
を超える蛋白質結晶のd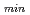 =2.0
=2.0 の反射が、分離可能となり得ることが分かった。
の反射が、分離可能となり得ることが分かった。
海野 昌喜*; 石川 久美子*; 日下 勝弘*; 玉田 太郎; 萩原 義徳*; 杉島 正一*; 和田 啓*; 山田 太郎*; 友寄 克亮; 細谷 孝明*; et al.
Journal of the American Chemical Society, 137(16), p.5452 - 5460, 2015/04
被引用回数:28 パーセンタイル:63.97(Chemistry, Multidisciplinary)シアノバクテリアや高等植物等の光合成生物は細胞内にビリン色素と呼ばれる集光色素を有している。ビリン還元酵素PcyAはビリベルジン(BV)を2段階で還元する反応を触媒することによりビリン色素の1つであるフィコシアノビリンを合成する。今回、我々はシアノバクテリア由来PcyAの立体構造をBVとの複合体状態で中性子結晶解析により決定した。BVは2つの状態(通常の状態と1つ水素が付いたBVH の状態)で存在していたが、近接したPcyA中のAsp105もBVの状態に対応して2つの状態(プロトン化および解離状態)で存在していた。また、X線構造解析では照射還元により確認できなかったBV中のA環近くの「アキシアル」水分子の存在を確認することができた。さらに、BV近傍に位置するHis88がプロトン化状態で存在しBV中のA環のラクタム酸素と水素結合を形成していることも確認したが、このHis88と隣接したHis74の間の水分子がH
の状態)で存在していたが、近接したPcyA中のAsp105もBVの状態に対応して2つの状態(プロトン化および解離状態)で存在していた。また、X線構造解析では照射還元により確認できなかったBV中のA環近くの「アキシアル」水分子の存在を確認することができた。さらに、BV近傍に位置するHis88がプロトン化状態で存在しBV中のA環のラクタム酸素と水素結合を形成していることも確認したが、このHis88と隣接したHis74の間の水分子がH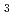 O
O の状態で存在することも明らかにした。これらの知見はAsp105, His88および「アキシアル」水分子がPcyAによる触媒反応におけるプロトン移動に関与していることを示唆しており、フィコシアノビリン合成(初期段階)の新たな反応機構の提唱を可能とした。
の状態で存在することも明らかにした。これらの知見はAsp105, His88および「アキシアル」水分子がPcyAによる触媒反応におけるプロトン移動に関与していることを示唆しており、フィコシアノビリン合成(初期段階)の新たな反応機構の提唱を可能とした。
友寄 克亮; 平野 優; 栗原 和男; 玉田 太郎
Journal of Physics; Conference Series, 664, p.072049_1 - 072049_7, 2015/00
被引用回数:4 パーセンタイル:81.62(Physics, Nuclear)蛋白質等の生体高分子の単結晶回折測定において、プロファイル関数を用いた積分法は弱いブラッグ反射の積分強度精度の向上に有効な手法であり、大強度陽子加速器施設(J-PARC)をはじめとする国内外の大強度パルス中性子線源に設置された単結晶回折装置における回折データ処理においても、その有効性が期待されている。本手法を中性子回折データ処理に適応する場合、水素原子の非干渉性散乱由来の強いバックグラウンドを正確に見積もることが鍵となる。我々は、バックグラウンド評価の際に、統計的に強度の弱いピークを認識するだけでなく、データソーススペクトルからの複数次元(x, y, TOF)のバックグラウンドの除去が可能なSNIP(Statistics-sensitive Nonlinear Iterative Peak-clipping)アルゴリズムを適用することを提案している。本研究では、蛋白質のパルス中性子回折実験で得られた実データのソーススペクトルに対して本アルゴリズムを適用することによるバックグラウンド除去を試みた。次に、TOFのピーク形状を忠実に再現するランダウあるいはバビロフ関数をガウス関数に畳み込んだ関数を、バックグラウンドを除去した一次元TOFヒストグラムデータに適用することにより、回折ピークへのフィッティングと積分を試みた。その結果、蛋白質結晶中の水素原子に起因する強いバックグラウンドに対して、空間方向だけでなく波長によってピーク幅が異なるTOF方向に対しても精度よくバックグラウンド除去が可能であることが分かった。
友寄 克亮; 日下 勝弘*; 山田 太郎*; 玉田 太郎
Journal of Structural and Functional Genomics, 15(3), p.131 - 135, 2014/09
J-PARCの物質生命科学施設(MLF)に、250 を超える単位胞を持つ結晶からの回折データ収集を可能とする生体高分子専用高分解能単結晶中性子回折装置の設計を計画している。この新しい回折計は、膜蛋白質や超分子などの巨大蛋白質の詳細構造解析のために利用される予定である。パルス幅時間分解能を考慮し、結合型減速材(CM)と非結合型減速材(DM)の強度およびパルス幅の定量的な比較を行った結果、CMよりもむしろDMが我々の目指す回折計の基準を満たすことが分かった。この結果は狭いパルス幅をもつDMが、大型単位格子をもつ結晶からのブラッグ反射の分離には、必要不可欠であることを示唆するものである。一方で、特に、大型単位格子の場合にはDMからの弱い信号が、水素原子の非干渉性散乱によって引き起こされる高いレベルのバックグランドの下に埋没してしまうということも念頭に置かねばならない。我々は、時間方向のパルス形状を忠実に再現するためのエネルギー損失関数とStatistics-sensitive Nonlinear Iterative Peak-clipping法による精度の高いバックグラウンド除去法を組み合わせた反射積分方法を提案する。
を超える単位胞を持つ結晶からの回折データ収集を可能とする生体高分子専用高分解能単結晶中性子回折装置の設計を計画している。この新しい回折計は、膜蛋白質や超分子などの巨大蛋白質の詳細構造解析のために利用される予定である。パルス幅時間分解能を考慮し、結合型減速材(CM)と非結合型減速材(DM)の強度およびパルス幅の定量的な比較を行った結果、CMよりもむしろDMが我々の目指す回折計の基準を満たすことが分かった。この結果は狭いパルス幅をもつDMが、大型単位格子をもつ結晶からのブラッグ反射の分離には、必要不可欠であることを示唆するものである。一方で、特に、大型単位格子の場合にはDMからの弱い信号が、水素原子の非干渉性散乱によって引き起こされる高いレベルのバックグランドの下に埋没してしまうということも念頭に置かねばならない。我々は、時間方向のパルス形状を忠実に再現するためのエネルギー損失関数とStatistics-sensitive Nonlinear Iterative Peak-clipping法による精度の高いバックグラウンド除去法を組み合わせた反射積分方法を提案する。
日下 勝弘*; 細谷 孝明*; 山田 太郎*; 友寄 克亮; 大原 高志; 片桐 政樹*; 栗原 和男; 田中 伊知朗*; 新村 信雄*
Journal of Synchrotron Radiation, 20(6), p.994 - 998, 2013/11
被引用回数:37 パーセンタイル:85.77(Instruments & Instrumentation)茨城生命物質構造解析装置iBIXは、主にあらゆる生命維持に関わる生体巨大分子の水素、プロトネーションや水和構造解明を目的とした飛行時間型中性子単結晶回折計である。2008年後半から、iBIXは茨城大学の支援によりユーザ実験に利用されている。2012年8月から既存の14台の検出器の更新が行われ、16台の新しい検出器がiBIXに設置された。現在の回折計の測定効率は、加速器出力の増加に伴い、以前の測定効率に比べて1オーダ改善した。2012年12月には、アップグレードされた検出器を用いた運用のコミッショニングに成功し、標準蛋白質であるリボヌクレアーゼAの回折データセット収集が試みられた。検出器アップグレード以前データ収集を行ったリボヌクレアーゼAの結果と比較し、最新のiBIXの性能評価を実施した結果、回折データの分解能、等価反射強度および構造精密化のR-factorが劇的に改善した。iBIXは世界で最も高性能な生物専用の中性子単結晶回折装置の一つであると予想される。
 -thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex
-thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex山田 太郎*; 栗原 和男; 大西 裕季*; 玉田 太郎; 友寄 克亮; 桝見 賢司*; 田中 伊知朗*; 黒木 良太; 新村 信雄*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1834(8), p.1532 - 1538, 2013/08
被引用回数:17 パーセンタイル:48.29(Biochemistry & Molecular Biology) -トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6
-トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6 )/中性子(2.8
)/中性子(2.8 )単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25
)単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25 のX線結晶構造解析により評価した。この複合体は、
のX線結晶構造解析により評価した。この複合体は、 -トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD
-トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD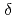 1とD
1とD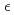 2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO
2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO 周囲には有意な中性子散乱長密度が観察されなかった。また、そのO
周囲には有意な中性子散乱長密度が観察されなかった。また、そのO は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO
は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
横山 武司*; 水口 峰之*; 鍋島 裕子*; 日下 勝弘*; 山田 太郎*; 細谷 孝明*; 大原 高志*; 栗原 和男; 友寄 克亮*; 田中 伊知朗*; et al.
Journal of Structural Biology, 177(2), p.283 - 290, 2012/02
被引用回数:48 パーセンタイル:83.20(Biochemistry & Molecular Biology)Transthyretin (TTR) is a tetrameric protein associated with human amyloidosis. In vitro, the formation of amyloid fibrils by TTR is known to be promoted by low pH. Here we show the neutron structure of TTR, focusing on the hydrogen bonds, protonation states and pH sensitivities. A large crystal was prepared at pD 7.4 for neutron protein crystallography. Neutron diffraction studies were conducted using the IBARAKI Biological Crystal Diffractometer with the time-of-flight method. The neutron structure solved at 2.0  resolution revealed the protonation states of His88 and the detailed hydrogen-bond network depending on the protonation states of His88. This hydrogen-bond network is composed of Thr75, Trp79, His88, Ser112, Pro113, Thr118-B and four water molecules, and is involved in both monomer-monomer and dimer-dimer interactions, suggesting that the double protonation of His88 by acidification breaks the hydrogen-bond network and causes the destabilization of the TTR tetramer. In addition, the comparison with X-ray structure at pH 4.0 indicated that the protonation occurred to Asp74, His88 and Glu89 at pH 4.0. Our neutron model provides insights into the molecular stability of TTR related to the hydrogen-bond network, the pH sensitivity and the CH...O weak hydrogen bond.
resolution revealed the protonation states of His88 and the detailed hydrogen-bond network depending on the protonation states of His88. This hydrogen-bond network is composed of Thr75, Trp79, His88, Ser112, Pro113, Thr118-B and four water molecules, and is involved in both monomer-monomer and dimer-dimer interactions, suggesting that the double protonation of His88 by acidification breaks the hydrogen-bond network and causes the destabilization of the TTR tetramer. In addition, the comparison with X-ray structure at pH 4.0 indicated that the protonation occurred to Asp74, His88 and Glu89 at pH 4.0. Our neutron model provides insights into the molecular stability of TTR related to the hydrogen-bond network, the pH sensitivity and the CH...O weak hydrogen bond.
田中 伊知朗*; 日下 勝弘*; 細谷 孝明*; 新村 信雄*; 大原 高志*; 栗原 和男; 山田 太郎*; 大西 裕季*; 友寄 克亮*; 横山 武司*
Acta Crystallographica Section D, 66(11), p.1194 - 1197, 2010/11
被引用回数:49 パーセンタイル:94.53(Biochemical Research Methods)次世代中性子線源であるJ-PARCに建設された茨城県生命物質構造解析装置(iBIX)は、2008年12月から運転を開始した。有機化合物結晶を用いた予備的な測定及び構造解析の結果、iBIXはJ-PARCの最終出力の1/8にあたる120kWでも十分な測定効率を発揮しており、タンパク質結晶の構造解析にも十分対応できることが明らかとなった。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域である。この領域においても、中性子結晶構造解析から得られる水素原子や水和水の立体構造情報は、タンパク質の機能解明や高機能化に大きく寄与する。しかし、ここで対象となるタンパク質は高分子量のものが多く、試料結晶の単位胞体積も大きくなり、既存の中性子回折装置では対応できていない。そこで我々は、パルス中性子源を有するJ-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標値:格子長250 )をも測定可能にするタンパク質単結晶専用の中性子回折装置の建設を提案し、J-PARC中性子実験装置部会において平成24年9月に2次(最終)審査に合格した。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。以上を実現するために必要な大面積検出器(300mm
)をも測定可能にするタンパク質単結晶専用の中性子回折装置の建設を提案し、J-PARC中性子実験装置部会において平成24年9月に2次(最終)審査に合格した。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。以上を実現するために必要な大面積検出器(300mm 300mm程度)については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行う。本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
300mm程度)については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行う。本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
J-PARCの物質生命科学施設(MLF)に建設予定の生体高分子専用高分解能単結晶中性子回折装置では、生命現象の基盤となる役割を担っている膜蛋白質などの大型蛋白質の中性子構造解析を対象とする。したがって反射スポットの分離が鍵となるため線源にはパルス幅が短い非結合型減速材(DM)を選択する。しかしDMから得られる中性子強度が比較的弱いことに加えて、対象とする蛋白質の単位格子体積が大きいため反射強度が弱く、水素原子からの非干渉性散乱の効果が大きいため十分なS/Nが得られない。さらに入射中性子パルス形状が時間方向に非対称な分布を持つためこの問題が顕在化する。本内容は、時間方向のパルス形状を忠実に再現するための関数と精度の高いバックグラウンド除去法を組み合わせた反射積分方法の開発に関する提案である。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
構造生物学研究において、膜タンパク質やタンパク質複合体などの大型タンパク質は重要な研究対象の一つである。これら大型タンパク質の水素原子や水和水を含む立体構造解析から、機能メカニズムを解明することは、生命科学に大きな進展をもたらす。我々は、J-PARCに大型単位格子を持つタンパク質結晶の中性子回折実験を可能とする新装置の建設を提案している。本装置ではビーム強度と反射分離を考慮し、線源にはパルス時間幅が短い減速材(非結合型)を選択した。大型単位格子を持つタンパク質を解析する場合、第一に高次反射が重なること。第二に格子体積が大きいために、反射強度の低下や水素原子からの非干渉性散乱によって十分なS/Nが得られないことが問題となる。第一の問題の克服には、ビームの角度分散および時間分解能の2つが鍵となる。低角検出器では、角度分散が支配的であるが、検出器散乱角が大きくなるに従い時間分解能が無視できなくなり、飛行距離による反射分離が可能となる。そこで高角検出器と飛行距離を有効に用いる測定を実現する必要がある。第二の問題の克服には、中性子スーパーミラーガイド管の最適な配置と臨界角の選択、さらにバックグラウンドとなりうる高速の中性子や 線の削減などを考慮する必要がある。これらの問題解決に向けてシミュレーションを行い、装置分解能と試料位置強度の評価を行い、分解可能な最大格子定数や測定時間の正確な評価を行った結果を報告する。
線の削減などを考慮する必要がある。これらの問題解決に向けてシミュレーションを行い、装置分解能と試料位置強度の評価を行い、分解可能な最大格子定数や測定時間の正確な評価を行った結果を報告する。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
中性子蛋白質結晶学によって得られる水素原子や水和の構造情報は、蛋白質の機能および、機能改善の解明への貢献が期待されている。しかし、多くの蛋白質は、特に膜蛋白質や蛋白質複合体は、大きい分子量を持ちそれゆえ結晶の単位格子は大きな体積を持つ。これは通常の回折計の測定し得る単位格子体積の領域の範囲外である。われわれは、J-PARC/MLFにおいて格子定数250 を超える単位格子体積を持つ結晶の回折データを収集することが可能な高分解能生体高分子用の中性子TOF回折計を設計することを予定している。強度とパルス幅の観点から線源として高分解能回折計に適した非結合型液体水素減速材を選択した。本装置は、装置分解能
を超える単位格子体積を持つ結晶の回折データを収集することが可能な高分解能生体高分子用の中性子TOF回折計を設計することを予定している。強度とパルス幅の観点から線源として高分解能回折計に適した非結合型液体水素減速材を選択した。本装置は、装置分解能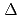
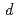 /
/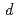 =1%に対して、大きな波長バンド幅と2.5mm空間分解能の大立体角シンチレーション検出器により、高いスループットおよび最小ピーク分離とS/Nを実現する予定である。装置の角度分解能は低角で支配的であるが、高角の背面散乱では非常に小さくなる。その結果、時間分解能の散乱角依存性が、散乱角が大きくなるにつれてより明白になる。大型単位格子蛋白質結晶を対象にした新装置の設計のためには、できるだけ長い飛行距離L1を取ることが有効である。要求される特徴をもつ装置設計のためには、高い柔軟性がビームライン設計には不可欠である。ここでは、我々は、McStasシミュレーション結果を含め、ビームラインコンポーネントの基礎的な考えと実験装置を報告する。
=1%に対して、大きな波長バンド幅と2.5mm空間分解能の大立体角シンチレーション検出器により、高いスループットおよび最小ピーク分離とS/Nを実現する予定である。装置の角度分解能は低角で支配的であるが、高角の背面散乱では非常に小さくなる。その結果、時間分解能の散乱角依存性が、散乱角が大きくなるにつれてより明白になる。大型単位格子蛋白質結晶を対象にした新装置の設計のためには、できるだけ長い飛行距離L1を取ることが有効である。要求される特徴をもつ装置設計のためには、高い柔軟性がビームライン設計には不可欠である。ここでは、我々は、McStasシミュレーション結果を含め、ビームラインコンポーネントの基礎的な考えと実験装置を報告する。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域である。しかし、ここで対象となるタンパク質は高分子量であるため、試料結晶の単位胞体積も大きくなり、従来の中性子回折装置では対応できていない。そこで我々は、パルス中性子源を有するJ-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標格子長250 )をも測定可能にする中性子回折装置の建設を提案している。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。L1=33.5m、ビーム角度分散0.4deg、結晶サイズ2mm角という条件の下、本装置は各格子長220
)をも測定可能にする中性子回折装置の建設を提案している。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。L1=33.5m、ビーム角度分散0.4deg、結晶サイズ2mm角という条件の下、本装置は各格子長220 を持つ結晶からの2.0
を持つ結晶からの2.0 分解能の回折スポットを分離可能であると評価されている。本装置を実現するために必要な大面積検出器(300mm
分解能の回折スポットを分離可能であると評価されている。本装置を実現するために必要な大面積検出器(300mm 300mm程度)は、J-PARCセンター・中性子基盤セクションと連携して開発を行っている。最終的に本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
300mm程度)は、J-PARCセンター・中性子基盤セクションと連携して開発を行っている。最終的に本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
J-PARC/MLFに設置された既存の回折計におけるデータ収集システムは、いくつかのDAQ PCとストレージサーバー、およびクライアントから構成されている。我々が新たに設置準備を進めている生体高分子専用回折計では、これらに加えて、イベントデータやヒストグラムデータの一元管理と過去の測定データと測定中のデータの比較を実現するために、分散データの場所を管理するインデックスサーバーを新たに導入することを考えている。また、データの信頼性と処理速度性能を向上するため、短期保存用(SSD)と長期保存用(RAID)の2段階のストレージを用意する予定であるが、第一段階の短期保存用(SSD)には、データ復旧時間を考慮し、分散複製型のファイルシステムを導入することを検討している。データ収集系の基幹コンポーネントとしては、J-PARC/MLF標準データ収集ミドルウェアであるDAQ-middlewareと、その他の装置制御およびパラメータ取得を統括するフレームワークであるIROHAを採用予定である。新しい回折計データ収集ソフトウェアでは、測定状態をモニターするためのリアルタイムストリーミング機能及び、TOF単結晶中性子回折測定に特化した簡易的なピークサーチ、セル決定、指数付け、積分機能を含む解析機能も測定の有効性を確認するために実装したいと考えている。これにより、回折データ収集に適した結晶の選択を簡便に評価できる機能を実験者に提供することが可能になる。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造情報に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域である。この領域において、中性子解析から得られる水素原子や水和水の詳細構造はその機能解明に大きく寄与する。しかし、ここで対象となるタンパク質は高分子量であるため、試料結晶の単位胞体積も大きくなり、従来の中性子回折装置では対応できていない。そこで我々は、パルス中性子源を有するJ-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標格子長250 )をも測定可能にする中性子回折装置の建設を提案している。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(
)をも測定可能にする中性子回折装置の建設を提案している。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(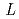 2=800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。
2=800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。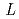 1=33.5m、ビーム角度分散0.4
1=33.5m、ビーム角度分散0.4 、結晶サイズ2mm角という条件の下、本装置は中・高角側の散乱角2
、結晶サイズ2mm角という条件の下、本装置は中・高角側の散乱角2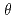
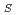 において1%の装置分解能を与え、かつ各格子長220
において1%の装置分解能を与え、かつ各格子長220 を持つ結晶からの2.0
を持つ結晶からの2.0 分解能の回折スポットを分離可能であると評価されている。高効率測定のため、大面積検出器(空間分解能
分解能の回折スポットを分離可能であると評価されている。高効率測定のため、大面積検出器(空間分解能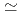 2.5mm、有感面積
2.5mm、有感面積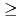 300mm
300mm 300mm)が開発中であり、これを40台以上設置することによって33%以上の立体角をカバーする予定である。
300mm)が開発中であり、これを40台以上設置することによって33%以上の立体角をカバーする予定である。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域である。しかし、ここで対象となる高分子量タンパク質は、試料結晶の単位胞体積も大きくなり、既存の中性子回折装置では対応できていない。そこで我々は、J-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標値: 格子長250 )をも測定可能にする中性子回折装置の建設プロジェクトを推進している(J-PARC中性子実験装置部会での2次審査合格済)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。以上を実現するために必要な大面積検出器(有感面積
)をも測定可能にする中性子回折装置の建設プロジェクトを推進している(J-PARC中性子実験装置部会での2次審査合格済)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。以上を実現するために必要な大面積検出器(有感面積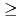 300mm
300mm 300mm。空間分解能
300mm。空間分解能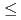 2.5mm。設置数
2.5mm。設置数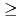 40台。立体角カバー率
40台。立体角カバー率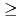 33%)については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行っている。一方、中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ400mm
33%)については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行っている。一方、中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ400mm 幅600mm。波長2.86
幅600mm。波長2.86 以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。McStasコードによる軌跡シミュレーションから、試料位置での強度は5
以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。McStasコードによる軌跡シミュレーションから、試料位置での強度は5 10
10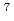 /cm
/cm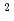 /s(波長1.5
/s(波長1.5 - 5.6
- 5.6 (第1フレーム))と見積られている。
(第1フレーム))と見積られている。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域であり、中性子結晶構造解析から得られる水素原子や水和水の立体構造情報は、タンパク質の機能解明や高機能化に大きく寄与する。しかし、ここで対象となる高分子量タンパク質は、試料結晶の単位胞体積も大きくなり、既存の中性子回折装置では対応できていない。そこで我々は、J-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標値:格子長250 )をも測定可能にする中性子回折装置の建設を推進している(J-PARC中性子実験装置部会での2次(最終)審査合格済み)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ40mm
)をも測定可能にする中性子回折装置の建設を推進している(J-PARC中性子実験装置部会での2次(最終)審査合格済み)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ40mm 幅60mm。波長2.86
幅60mm。波長2.86 以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。また、垂直方向は、スーパーミラー反射回数の増加による強度の低減を図るため楕円形状した。水平方向では、不要な
以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。また、垂直方向は、スーパーミラー反射回数の増加による強度の低減を図るため楕円形状した。水平方向では、不要な 線や波長の短い中性子を除去するため、曲管形状を取り入れた。McStasコードによる軌跡シミュレーションから、試料位置での強度は5
線や波長の短い中性子を除去するため、曲管形状を取り入れた。McStasコードによる軌跡シミュレーションから、試料位置での強度は5 10
10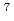 /cm
/cm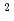 /s(波長1.5
/s(波長1.5 -5.6
-5.6 (第1フレーム))と見積られている。
(第1フレーム))と見積られている。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
構造生物学研究において、膜タンパク質やタンパク質複合体などの大型タンパク質は重要な研究対象の一つである。これらの大型タンパク質の水素原子や水和水を含む立体構造解析から、機能メカニズムを解明することは、生命科学に大きな進展をもたらす。我々は、J-PARC(大強度陽子加速器施設)に大型単位格子をもつタンパク質結晶の中性子回折実験を可能とする新装置の建設を提案している。散乱実験での飛行時間測定法において一番の長所は飛行距離を大きくとることによりエネルギー(あるいは時間)分解能を改善することが可能であることである。J-PARCに建設予定の新装置でも飛行距離を大きくとることにより長格子タンパク質の測定も可能になるが、ビームラインの設置の物理的な制約もありパルス幅が比較的短い非結合型減速材(DM)を新装置の線源として優先的に検討している。しかしJ-PARC/MLFには、他にさらに強度が強い結合型減速材(CM)やよりパルス幅が短い非結合型ポイゾン減速材(PM)の2種類の減速材も存在する。J-PARC/MLFの3種類の線源データを用いて、簡易的な装置モデルを用いて長格子(~250 )測定実現のための装置パラメータの評価を行った。低角バンクの検出器では面間隔の決定精度が悪化するため角度分散を改善できるようコリメータやスリット等での調整が必要となる。散乱角に依存した反射分離評価を行い、最適なL1(第一飛行距離), L2(カメラ長)および発散角を検討したのでポスターにて報告する。
)測定実現のための装置パラメータの評価を行った。低角バンクの検出器では面間隔の決定精度が悪化するため角度分散を改善できるようコリメータやスリット等での調整が必要となる。散乱角に依存した反射分離評価を行い、最適なL1(第一飛行距離), L2(カメラ長)および発散角を検討したのでポスターにて報告する。
玉田 太郎; 平野 優; 友寄 克亮; 栗原 和男
no journal, ,
原子力機構にはタンパク質の結晶構造解析に供することができる2つの中性子源が存在する。1つは研究用原子炉JRR-3で、我々のグループは2台の中性子回折計(BIX-3/4)を設置・管理しているが、東日本大震災以降、稼働停止状態が続いている。もう1つは大強度陽子加速器施設J-PARCの物質・生命科学実験施設MLFで、茨城県が設置した生命物質構造解析装置(iBIX)が運用中である。上記の現状を踏まえ、最近我々はiBIXを利用した中性子回折実験を積極的に展開している。この2年間に、4つのタンパク質の中性子回折データを収集したが、うち2つのタンパク質(電子伝達タンパク質)については1.1 および1.4
および1.4 分解能とタンパク質としては高い分解能での回折データ収集に成功している。引き続き、構造解析を実施中であるが、興味深い水素原子の挙動も多数確認している。さらに、我々はMLFに新たな生体高分子専用中性子回折装置の設置準備を進めている。この装置は、大型単位格子(目標250
分解能とタンパク質としては高い分解能での回折データ収集に成功している。引き続き、構造解析を実施中であるが、興味深い水素原子の挙動も多数確認している。さらに、我々はMLFに新たな生体高分子専用中性子回折装置の設置準備を進めている。この装置は、大型単位格子(目標250 )結晶からの回折データ収集が可能なように設計している。この新装置が稼働することにより、これまで解析の対象となりえていなかった膜タンパク質やタンパク質複合体の中性子結晶構造解析が実現すると考えている。設置に向けて、技術的にも解決しなければならない課題が複数存在しているが、J-PARCセンターと共同で課題解決に取り組んでいる。本発表では、原子力機構における上記の取り組みについて紹介する。
)結晶からの回折データ収集が可能なように設計している。この新装置が稼働することにより、これまで解析の対象となりえていなかった膜タンパク質やタンパク質複合体の中性子結晶構造解析が実現すると考えている。設置に向けて、技術的にも解決しなければならない課題が複数存在しているが、J-PARCセンターと共同で課題解決に取り組んでいる。本発表では、原子力機構における上記の取り組みについて紹介する。
大原 高志; 日下 勝弘*; 細谷 孝明; 栗原 和男; 友寄 克亮*; 新村 信雄*; 田中 伊知朗*; 鈴木 次郎*; 中谷 健; 大友 季哉*; et al.
no journal, ,
単結晶回折計にとって、生データから各ブラッグ反射の強度情報を抽出し、HKLFリストを出力するためのデータ処理ソフトウェアは必要不可欠である。われわれは、J-PARCに建設中の生体分子用単結晶中性子回折計iBIXで用いるためのデータ処理ソフトウェアの開発を行っている。このソフトウェアは生データ処理機能と生データ可視化機能から構成されており、単結晶回折データを処理するための基本機能に加えて格子定数の大きなタンパク質結晶を取り扱うための機能として「実空間インデックス機能」や「重なったブラッグピークの判別機能」等を備えている。