Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
篠原 彩花*; 花岡 宏史*; 坂下 哲哉*; 佐藤 達彦; 山口 藍子*; 石岡 典子*; 対馬 義人*
Annals of Nuclear Medicine, 32(2), p.114 - 122, 2018/02
被引用回数:9 パーセンタイル:38.49(Radiology, Nuclear Medicine & Medical Imaging)オージェ放出核種を用いた放射線治療は、高い治療効果と低い正常組織反応を期待できる。本研究では、オージェ放出核種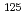 Iと
Iと 線放出核種
線放出核種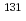 Iを2次元と3次元の培養細胞に取り込ませて、その細胞致死率を測定した。また、粒子・重イオン輸送計算コードPHITSを用いて、各条件に対する細胞の吸収線量分布を精度よく計算し、細胞生存率と吸収線量の関係について評価した。その結果、
Iを2次元と3次元の培養細胞に取り込ませて、その細胞致死率を測定した。また、粒子・重イオン輸送計算コードPHITSを用いて、各条件に対する細胞の吸収線量分布を精度よく計算し、細胞生存率と吸収線量の関係について評価した。その結果、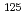 I治療は
I治療は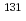 I治療と比較して、2次元培養細胞の場合はほぼ同程度の効果が得られるが、3次元培養細胞の場合は治療効果が低いことが分かった。これは、クロスファイア効果と呼ばれる一本の
I治療と比較して、2次元培養細胞の場合はほぼ同程度の効果が得られるが、3次元培養細胞の場合は治療効果が低いことが分かった。これは、クロスファイア効果と呼ばれる一本の 線が複数の細胞をヒットする効果と、薬剤が培養細胞内に均一に分布しない効果に起因すると考えられる。
線が複数の細胞をヒットする効果と、薬剤が培養細胞内に均一に分布しない効果に起因すると考えられる。
 Br-
Br- -methyl-phenylalanine for tumor PET imaging
-methyl-phenylalanine for tumor PET imaging花岡 宏史*; 大島 康宏; 鈴木 結利花*; 山口 藍子*; 渡辺 茂樹; 上原 知也*; 永森 收志*; 金井 好克*; 石岡 典子; 対馬 義人*; et al.
Journal of Nuclear Medicine, 56(5), p.791 - 797, 2015/05
被引用回数:21 パーセンタイル:62.87(Radiology, Nuclear Medicine & Medical Imaging)Radiolabeled amino acids are superior PET tracers for imaging of malignant tumors, and amino acids labeled with  Br, an attractive positron emitter due to its relatively long half-life (t
Br, an attractive positron emitter due to its relatively long half-life (t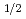 =16.2 h), could potentially be widely usable tumor imaging tracer. In this study, in consideration of stability and tumor specificity, 2-
=16.2 h), could potentially be widely usable tumor imaging tracer. In this study, in consideration of stability and tumor specificity, 2- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (2-
-methyl-L-phenylalanine (2- Br-BAMP) and 4-
Br-BAMP) and 4- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (4-
-methyl-L-phenylalanine (4- Br-BAMP) were designed and their potential as a tumor imaging agent was evaluated. No-carrier-added
Br-BAMP) were designed and their potential as a tumor imaging agent was evaluated. No-carrier-added  Br and
Br and  Br, the latter of which is suitable radiobromine for basic studies due to its longer half-life (t
Br, the latter of which is suitable radiobromine for basic studies due to its longer half-life (t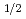 = 57.1 h), were produced. Both
= 57.1 h), were produced. Both  Br-BAMPs were stable in the plasma and in the murine body. In biodistribution studies, 2-
Br-BAMPs were stable in the plasma and in the murine body. In biodistribution studies, 2- Br-BAMP showed more rapid blood clearance and lower renal accumulation than did 4-
Br-BAMP showed more rapid blood clearance and lower renal accumulation than did 4- Br-BAMP. More than 90% of injected radioactivity was excreted in the urine by 6 h post-injection of 2-
Br-BAMP. More than 90% of injected radioactivity was excreted in the urine by 6 h post-injection of 2- Br-BAMP. High tumor accumulation of 2-
Br-BAMP. High tumor accumulation of 2- Br-BAMP was observed in tumor-bearing mice and PET imaging with 2-
Br-BAMP was observed in tumor-bearing mice and PET imaging with 2- Br-BAMP enabled clear visualization of the tumor. These findings suggest that 2-
Br-BAMP enabled clear visualization of the tumor. These findings suggest that 2- Br-BAMP would constitute a potential new PET tracer for tumor imaging and may eventually enable the wider use of amino acid tracers.
Br-BAMP would constitute a potential new PET tracer for tumor imaging and may eventually enable the wider use of amino acid tracers.
大島 康宏; 対馬 義人*
放射線と産業, (136), p.9 - 12, 2014/06
3-[ F]フルオロ
F]フルオロ メチルLチロシン(L-[
メチルLチロシン(L-[ F]FAMT)は、癌特異性が非常に高く、L-[
F]FAMT)は、癌特異性が非常に高く、L-[ F]FAMT-PETによる癌の正確な診断が可能である。しかし、L-[
F]FAMT-PETによる癌の正確な診断が可能である。しかし、L-[ F]FAMTには高度な腎集積・滞留が認められ、体内クリアランス遅延により生ずる癌-正常組織間のコントラスト低下によって、癌と正常組織の境界は分かりづらい。我々は癌をより明瞭に把握できるようにするため、D体アミノ酸の正常組織集積が少なく、腎臓から尿中排泄されやすい特徴に着目し、3-[
F]FAMTには高度な腎集積・滞留が認められ、体内クリアランス遅延により生ずる癌-正常組織間のコントラスト低下によって、癌と正常組織の境界は分かりづらい。我々は癌をより明瞭に把握できるようにするため、D体アミノ酸の正常組織集積が少なく、腎臓から尿中排泄されやすい特徴に着目し、3-[ F]フルオロ
F]フルオロ メチルDチロシン(D-[
メチルDチロシン(D-[ F]FAMT)を新たに合成して、その有用性を検討した。
F]FAMT)を新たに合成して、その有用性を検討した。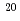 Ne(d,
Ne(d, )
) F反応により製造した
F反応により製造した F
F ガスを酢酸-酢酸カリウム溶液中に吹き込み、CH
ガスを酢酸-酢酸カリウム溶液中に吹き込み、CH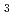 COO
COO Fとした後、
Fとした後、 メチルDチロシンと反応させてD-[
メチルDチロシンと反応させてD-[ F]FAMTを合成した。担癌マウスにおける体内分布を検討した結果、D-[
F]FAMTを合成した。担癌マウスにおける体内分布を検討した結果、D-[ F]FAMTはL-[
F]FAMTはL-[ F]FAMTに比べ、正常組織集積が少なく、素早く血中から消失した。特に腎集積・滞留は、D-[
F]FAMTに比べ、正常組織集積が少なく、素早く血中から消失した。特に腎集積・滞留は、D-[ F]FAMTで顕著な低下が認められた。D-[
F]FAMTで顕著な低下が認められた。D-[ F]FAMTの癌への集積量はL-[
F]FAMTの癌への集積量はL-[ F]FAMTに比べ低かったものの、D-[
F]FAMTに比べ低かったものの、D-[ F]FAMTは正常組織に比べ、癌に十分な集積・滞留を示した。小動物用PET撮像装置によるPET撮像を行った結果、D-[
F]FAMTは正常組織に比べ、癌に十分な集積・滞留を示した。小動物用PET撮像装置によるPET撮像を行った結果、D-[ F]FAMTによってL-[
F]FAMTによってL-[ F]FAMTよりも癌を明瞭にイメージングすることができた。以上より、D-[
F]FAMTよりも癌を明瞭にイメージングすることができた。以上より、D-[ F]FAMTの新規PET診断薬としての有用性が示唆された。
F]FAMTの新規PET診断薬としての有用性が示唆された。
 -methyltyrosine (FAMT) uptake on PET in patients with oesophageal cancer
-methyltyrosine (FAMT) uptake on PET in patients with oesophageal cancer鈴木 茂正*; 解良 恭一*; 大島 康宏; 石岡 典子; 宗田 真*; 横堀 武彦*; 宮崎 達也*; 織内 昇*; 富永 英之*; 金井 好克*; et al.
British Journal of Cancer, 110(8), p.1985 - 1991, 2014/04
被引用回数:26 パーセンタイル:58.91(Oncology)Fluorine-18- -methyltyrosine (FAMT) as an amino acid tracer for positron emission tomography (PET) is useful for detecting human neoplasms. FAMT is accumulated in tumor cells solely via L-type amino acid transporter 1 (LAT1). This study was conducted to investigate the biological significance of FAMT uptake in patients with esophageal cancer. From April 2008 to December 2011, 42 patients with esophageal cancer underwent both FAMT PET and FDG PET before surgical treatment. The immunohistochemical analysis of LAT1, CD98, Ki-67, CD34, p53, p-Akt and p-mTOR was performed on the primary lesions.
-methyltyrosine (FAMT) as an amino acid tracer for positron emission tomography (PET) is useful for detecting human neoplasms. FAMT is accumulated in tumor cells solely via L-type amino acid transporter 1 (LAT1). This study was conducted to investigate the biological significance of FAMT uptake in patients with esophageal cancer. From April 2008 to December 2011, 42 patients with esophageal cancer underwent both FAMT PET and FDG PET before surgical treatment. The immunohistochemical analysis of LAT1, CD98, Ki-67, CD34, p53, p-Akt and p-mTOR was performed on the primary lesions. 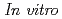 experiments were performed to examine the mechanism of FAMT uptake using LAT1 inhibitor, 2-aminobicyclo-(2,2,1)-heptane-2-carboxylic acid (BCH). High uptake of FAMT was significantly associated with advanced stage, lymph node metastasis and the expression of LAT1, CD98, Ki-67 and CD34. LAT1 expression yielded a statistically significant correlation with CD98 expression, cell proliferation, angiogenesis and glucose metabolism.
experiments were performed to examine the mechanism of FAMT uptake using LAT1 inhibitor, 2-aminobicyclo-(2,2,1)-heptane-2-carboxylic acid (BCH). High uptake of FAMT was significantly associated with advanced stage, lymph node metastasis and the expression of LAT1, CD98, Ki-67 and CD34. LAT1 expression yielded a statistically significant correlation with CD98 expression, cell proliferation, angiogenesis and glucose metabolism. 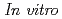 experiments revealed that FAMT was specifically transported by LAT1. The uptake of FAMT within tumor cells is determined by the LAT1 expression and correlated with cell proliferation and angiogenesis in esophageal cancer. The present experiments also confirmed the presence of LAT1 as an underlying mechanism of FAMT accumulation.
experiments revealed that FAMT was specifically transported by LAT1. The uptake of FAMT within tumor cells is determined by the LAT1 expression and correlated with cell proliferation and angiogenesis in esophageal cancer. The present experiments also confirmed the presence of LAT1 as an underlying mechanism of FAMT accumulation.
 F]fluoro-
F]fluoro- -methyl-D-tyrosine (D-[
-methyl-D-tyrosine (D-[ F]FAMT) as a novel amino acid tracer for positron emission tomography
F]FAMT) as a novel amino acid tracer for positron emission tomography大島 康宏; 花岡 宏史*; 富永 英之*; 金井 好克*; 解良 恭一*; 山口 藍子*; 永森 收志*; 織内 昇*; 対馬 義人*; 遠藤 啓吾*; et al.
Annals of Nuclear Medicine, 27(4), p.314 - 324, 2013/05
被引用回数:18 パーセンタイル:51.91(Radiology, Nuclear Medicine & Medical Imaging)Since D-amino acid is not distributed much in the non-target organs and is rapidly excreted in the urine, radiotracer using D-amino acid would allow clear PET image of the tumor early after administration. In this study, we prepared 3-[ F]fluoro-
F]fluoro- -methyl-D-tyrosine (D-[
-methyl-D-tyrosine (D-[ F]FAMT) and evaluated its usefulness. In biodistribution studies, D-[
F]FAMT) and evaluated its usefulness. In biodistribution studies, D-[ F]FAMT showed rapid clearance from the blood, marked accumulation and retention in the tumor and low accumulation in non-target organs. The amount of D-[
F]FAMT showed rapid clearance from the blood, marked accumulation and retention in the tumor and low accumulation in non-target organs. The amount of D-[ F]FAMT in the tumor was also lowered, tumor-to-blood ratio and tumor-to-muscle ratio of D-[
F]FAMT in the tumor was also lowered, tumor-to-blood ratio and tumor-to-muscle ratio of D-[ F]FAMT were similar to those of correspondign L-isomer, 3-[
F]FAMT were similar to those of correspondign L-isomer, 3-[ F]fluoro-
F]fluoro- -methyl-L-tyrosine (L-[
-methyl-L-tyrosine (L-[ F]FAMT), at every timepoint. Consequently, PET imaging with D-[
F]FAMT), at every timepoint. Consequently, PET imaging with D-[ F]FAMT could not show clear image of the tumor early after the administration. However, D-[
F]FAMT could not show clear image of the tumor early after the administration. However, D-[ F]FAMT enabled higher tumor-to-background contrast than L-[
F]FAMT enabled higher tumor-to-background contrast than L-[ F]FAMT. In conclusions, D-[
F]FAMT. In conclusions, D-[ F]FAMT showed rapid blood clearance, low accumulation in non-target organs, and tumor-selective image compared with L-[
F]FAMT showed rapid blood clearance, low accumulation in non-target organs, and tumor-selective image compared with L-[ F]FAMT. Thus, D-[
F]FAMT. Thus, D-[ F]FAMT could potentially serve as a novel PET tracer for imaging malignant tumors.
F]FAMT could potentially serve as a novel PET tracer for imaging malignant tumors.
 Br標識アミノ酸2-
Br標識アミノ酸2- Br-bromo-
Br-bromo- -methyl-L-phenylalanineの開発
-methyl-L-phenylalanineの開発大島 康宏; 花岡 宏史*; 鈴木 結利花*; 山口 藍子*; 渡辺 茂樹; 上原 知也*; 永森 收志*; 金井 好克*; 石岡 典子; 対馬 義人*; et al.
no journal, ,
本研究では、より生体内安定性の高い Br標識アミノ酸として、新たに2-
Br標識アミノ酸として、新たに2- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (2-
-methyl-L-phenylalanine (2- Br-BAMP)を合成し、新規PETイメージング薬としての有用性について検討した。放射性Br(
Br-BAMP)を合成し、新規PETイメージング薬としての有用性について検討した。放射性Br( Br及び
Br及び Br)はセレン化銅ターゲットに対してプロトンビーム(20MeV)を照射することで製造した。
Br)はセレン化銅ターゲットに対してプロトンビーム(20MeV)を照射することで製造した。 Brは半減期16.2時間の陽電子放出核種であることからPETイメージングに使用し、
Brは半減期16.2時間の陽電子放出核種であることからPETイメージングに使用し、 Brは半減期57.1時間の
Brは半減期57.1時間の 線放出核種であることから基礎検討に使用した。酸化剤存在下において、放射性Brと標識前駆体(2-trimethylstannyl-N-trifluoroacetyl-
線放出核種であることから基礎検討に使用した。酸化剤存在下において、放射性Brと標識前駆体(2-trimethylstannyl-N-trifluoroacetyl- -methyl-L-phenylalanine methyl ester)を反応させ、2-
-methyl-L-phenylalanine methyl ester)を反応させ、2- Br-BAMP及び2-
Br-BAMP及び2- Br-BAMPを合成した。HPLC分析の結果、標識率52.6
Br-BAMPを合成した。HPLC分析の結果、標識率52.6 11.9%、放射化学的純度95%以上で2-
11.9%、放射化学的純度95%以上で2- Br-BAMPの合成が可能であった。血清及びマウス体内における2-
Br-BAMPの合成が可能であった。血清及びマウス体内における2- Br-BAMPの分解はほとんど認められず、非常に高い安定性を示した。体内分布では、2-
Br-BAMPの分解はほとんど認められず、非常に高い安定性を示した。体内分布では、2- Br-BAMPは癌へ高度に集積する一方、血中からの消失は早く、投与放射能の90%以上が6時間以内に尿中に排泄され、正常臓器へ非常に低い集積を示した。さらに2-
Br-BAMPは癌へ高度に集積する一方、血中からの消失は早く、投与放射能の90%以上が6時間以内に尿中に排泄され、正常臓器へ非常に低い集積を示した。さらに2- Br-BAMPを用いてPET撮像を行った結果、癌を明瞭にイメージングすることができた。これらの結果より、2-
Br-BAMPを用いてPET撮像を行った結果、癌を明瞭にイメージングすることができた。これらの結果より、2- Br-BAMPの新規PETイメージング薬としての有用性が示唆された。
Br-BAMPの新規PETイメージング薬としての有用性が示唆された。
 F]fluoro-
F]fluoro- -methyl-D-tyrosine(D-[
-methyl-D-tyrosine(D-[ F]FAMT)のPET用新規アミノ酸トレーサーとしての生物学的評価
F]FAMT)のPET用新規アミノ酸トレーサーとしての生物学的評価大島 康宏; 花岡 宏史*; 富永 英之*; 金井 好克*; 解良 恭一*; 山口 藍子*; 永森 收志*; 織内 昇*; 対馬 義人*; 遠藤 啓吾*; et al.
no journal, ,
3-[ F]Fluoro-
F]Fluoro- -methyl-L-tyrosine(L-[
-methyl-L-tyrosine(L-[ F]FAMT)は臨床応用される有用なPositron Emission Tomography(PET)用アミノ酸トレーサーであるが、正常組織である腎臓及び膵臓に対しても高度に集積・滞留する。一方で、非天然アミノ酸であるD体アミノ酸は、L体に比べ正常組織への分布が非常に低く、速やかな血液クリアランス及び癌組織集積性を示すことから、D体アミノ酸を利用することで明瞭かつ癌組織選択的なPETイメージングを実現できる可能性がある。そこで、本研究では3-[
F]FAMT)は臨床応用される有用なPositron Emission Tomography(PET)用アミノ酸トレーサーであるが、正常組織である腎臓及び膵臓に対しても高度に集積・滞留する。一方で、非天然アミノ酸であるD体アミノ酸は、L体に比べ正常組織への分布が非常に低く、速やかな血液クリアランス及び癌組織集積性を示すことから、D体アミノ酸を利用することで明瞭かつ癌組織選択的なPETイメージングを実現できる可能性がある。そこで、本研究では3-[ F]fluoro-
F]fluoro- -methyl-D-tyrosine(D-[
-methyl-D-tyrosine(D-[ F]FAMT)を合成し、PET用アミノ酸トレーサーとしての有用性について検討した。体内分布実験の結果、D-[
F]FAMT)を合成し、PET用アミノ酸トレーサーとしての有用性について検討した。体内分布実験の結果、D-[ F]FAMTは非常に早い血液クリアランスを示し、投与直後に腎臓,膵臓への集積が認められたが、L-[
F]FAMTは非常に早い血液クリアランスを示し、投与直後に腎臓,膵臓への集積が認められたが、L-[ F]FAMTのような滞留は認められず、速やかに消失した。また、D-[
F]FAMTのような滞留は認められず、速やかに消失した。また、D-[ F]FAMTの癌組織集積量はL-[
F]FAMTの癌組織集積量はL-[ F]FAMTに比べて低かったが、正常組織分布も非常に低く、放射能の腫瘍血液比,腫瘍筋肉比はL-[
F]FAMTに比べて低かったが、正常組織分布も非常に低く、放射能の腫瘍血液比,腫瘍筋肉比はL-[ F]FAMTと同等な高値を示した。さらにPETイメージングの結果、D-[
F]FAMTと同等な高値を示した。さらにPETイメージングの結果、D-[ F]FAMTによってL-[
F]FAMTによってL-[ F]FAMTに比べて明瞭かつ癌組織選択的なPETイメージングが可能であることが示された。以上の結果より、D-[
F]FAMTに比べて明瞭かつ癌組織選択的なPETイメージングが可能であることが示された。以上の結果より、D-[ F]FAMTがPET用新規アミノ酸トレーサーとして有用であることが示唆された。
F]FAMTがPET用新規アミノ酸トレーサーとして有用であることが示唆された。
 F]fluoro-
F]fluoro- -methyl-D-tyrosine (D-[
-methyl-D-tyrosine (D-[ F]FAMT) as a novel amino acid tracer for positron emission tomography
F]FAMT) as a novel amino acid tracer for positron emission tomography大島 康宏; 花岡 宏史*; 富永 英之*; 金井 好克*; 解良 恭一*; 山口 藍子*; 永森 收志*; 織内 昇*; 対馬 義人*; 遠藤 啓吾*; et al.
no journal, ,
3-[ F]Fluoro-
F]Fluoro- -methyl-L-tyrosine (L-[
-methyl-L-tyrosine (L-[ F]FAMT) is a useful amino acid tracer, and it is selectively accumulated in the tumor without an incorporation in the protein synthesis. However, L-[
F]FAMT) is a useful amino acid tracer, and it is selectively accumulated in the tumor without an incorporation in the protein synthesis. However, L-[ F]FAMT is highly retained in the kidney, which causes the reduction of sensitivity for tumor detection by positron emission tomography (PET). L-amino acids have corresponding D-isomers which have some favorable properties for development of PET tracers. Since mammals rarely use D-amino acids for their biological activity, D-amino acids would not be taken up by the normal tissues. In addition, D-amino acids are highly excreted in the urine compared with L-isomers, and rapidly cleared from the circulation. Thus, D-isomer of FAMT would lower the high retention of L-isomer in the kidney and allow clear imaging of the tumor by PET. In this study, we synthesized 3-[
F]FAMT is highly retained in the kidney, which causes the reduction of sensitivity for tumor detection by positron emission tomography (PET). L-amino acids have corresponding D-isomers which have some favorable properties for development of PET tracers. Since mammals rarely use D-amino acids for their biological activity, D-amino acids would not be taken up by the normal tissues. In addition, D-amino acids are highly excreted in the urine compared with L-isomers, and rapidly cleared from the circulation. Thus, D-isomer of FAMT would lower the high retention of L-isomer in the kidney and allow clear imaging of the tumor by PET. In this study, we synthesized 3-[ F]fluoro-
F]fluoro- -methyl-D-tyrosine (D-[
-methyl-D-tyrosine (D-[ F]FAMT) and evaluated its potential. In biodistribution studies, D-[
F]FAMT) and evaluated its potential. In biodistribution studies, D-[ F]FAMT showed rapid clearance from blood, marked accumulation and retention in the tumor and low retention in non-target organs, especially kidney. Furthermore, PET imaging using D-[
F]FAMT showed rapid clearance from blood, marked accumulation and retention in the tumor and low retention in non-target organs, especially kidney. Furthermore, PET imaging using D-[ F]FAMT enabled clear visualization of implanted tumor, compared with L-[
F]FAMT enabled clear visualization of implanted tumor, compared with L-[ F]FAMT. In conclusion, D-[
F]FAMT. In conclusion, D-[ F]FAMT could potentially serve as a useful tracer for imaging malignant tumors.
F]FAMT could potentially serve as a useful tracer for imaging malignant tumors.
 At]astato-
At]astato- -methyl-L-phenylalanine (2-AAMP) as a novel radiopharmaceutical for internal radiotherapy
-methyl-L-phenylalanine (2-AAMP) as a novel radiopharmaceutical for internal radiotherapy大島 康宏; 鈴木 博元*; 花岡 宏史*; 渡辺 茂樹; 渡辺 智; 渡邉 直行*; 対馬 義人*; 遠藤 啓吾*; 荒野 泰*; 石岡 典子
no journal, ,
In this study, we newly synthesized 2-[ At]astato-
At]astato- -methyl-Lphenylalanine (2-AAMP) and investigated its possibility as a novel radiopharmaceutical for the internal radiotherapy.
-methyl-Lphenylalanine (2-AAMP) and investigated its possibility as a novel radiopharmaceutical for the internal radiotherapy.  At was produced via the
At was produced via the 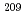 Bi(
Bi( , 2n)
, 2n) At reaction and separated from the Bi target by a dry-distillation technique. For 2-AAMP synthesis, 2-trimethylstannyl-
At reaction and separated from the Bi target by a dry-distillation technique. For 2-AAMP synthesis, 2-trimethylstannyl-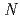 -trifluoroacetyl-
-trifluoroacetyl- -methyl-L-phenylalanine methyl ester was synthesized as a precursor and radioastatinated in the presence of
-methyl-L-phenylalanine methyl ester was synthesized as a precursor and radioastatinated in the presence of 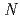 -chlorosuccinimide. The following deprotection reaction gave 2-AAMP in 18% yield. 2-AAMP was rapidly taken up into SKOV3 cells expressing L-type amino acid transporter 1 (LAT1) which is highly and specifically expressed in tumor cells. The uptake of 2-AAMP was significantly inhibited by not only the treatment with L-amino acids which are the substrates of LAT1, but also 2-amino-bicyclo[2,2,1]heptane-2-carboxylic acid, an inhibitor of LAT, indicating that 2-AAMP could be taken up through LAT1. Colony formation of SKOV3 was decreased to approx. 46% of control by the treatment with 2-AAMP for 22 h at 25 kBq/ml (initial concentration of radioactivity). These results suggest that 2-AAMP might be selectively accumulated in tumor and suppress growth of cancer. At present, stability, biodistribution and anti-tumor activity of 2-AAMP are under investigation.
-chlorosuccinimide. The following deprotection reaction gave 2-AAMP in 18% yield. 2-AAMP was rapidly taken up into SKOV3 cells expressing L-type amino acid transporter 1 (LAT1) which is highly and specifically expressed in tumor cells. The uptake of 2-AAMP was significantly inhibited by not only the treatment with L-amino acids which are the substrates of LAT1, but also 2-amino-bicyclo[2,2,1]heptane-2-carboxylic acid, an inhibitor of LAT, indicating that 2-AAMP could be taken up through LAT1. Colony formation of SKOV3 was decreased to approx. 46% of control by the treatment with 2-AAMP for 22 h at 25 kBq/ml (initial concentration of radioactivity). These results suggest that 2-AAMP might be selectively accumulated in tumor and suppress growth of cancer. At present, stability, biodistribution and anti-tumor activity of 2-AAMP are under investigation.
大島 康宏; 月本 光俊*; 対馬 義人*; 石岡 典子
no journal, ,
本研究では、RI内用療法における細胞外ATP放出および放出されたATPを介した癌の放射線抵抗性誘導について検討し、さらにP2受容体を標的とした新規放射線増感剤の可能性を検討した。RI内用療法薬として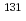 I標識トラスツズマブをクロラミンT法により調製し、ヒト上皮成長因子受容体2型高発現細胞であるSKOV3を用いて細胞増殖抑制効果を検討したところ、コロニー形成能は放射能濃度依存的に抑制された。次にSKOV3に対し
I標識トラスツズマブをクロラミンT法により調製し、ヒト上皮成長因子受容体2型高発現細胞であるSKOV3を用いて細胞増殖抑制効果を検討したところ、コロニー形成能は放射能濃度依存的に抑制された。次にSKOV3に対し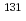 I標識トラスツズマブ(4MBq/ml)を添加したところ、添加後30分をピークとして細胞外へのATP放出が認められた。さらに、
I標識トラスツズマブ(4MBq/ml)を添加したところ、添加後30分をピークとして細胞外へのATP放出が認められた。さらに、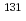 I標識トラスツズマブによる細胞増殖抑制はATP分解酵素であるApyraseの添加によって促進された。SKOV3におけるP2受容体発現をRT-PCR法により検討すると、P2X
I標識トラスツズマブによる細胞増殖抑制はATP分解酵素であるApyraseの添加によって促進された。SKOV3におけるP2受容体発現をRT-PCR法により検討すると、P2X , P2Y
, P2Y , P2Y
, P2Y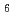 受容体の高発現が認められ、
受容体の高発現が認められ、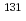 I標識トラスツズマブによる細胞増殖抑制は、P2Y
I標識トラスツズマブによる細胞増殖抑制は、P2Y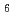 受容体選択的作動薬であるUDPの添加によって有意に抑制された。一方、P2Y
受容体選択的作動薬であるUDPの添加によって有意に抑制された。一方、P2Y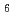 受容体選択的阻害薬であるMRS2578を添加すると、
受容体選択的阻害薬であるMRS2578を添加すると、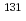 I標識トラスツズマブによる細胞増殖抑制は有意に促進された。以上より、RI内用療法において細胞外ATP放出が誘導され、P2Y
I標識トラスツズマブによる細胞増殖抑制は有意に促進された。以上より、RI内用療法において細胞外ATP放出が誘導され、P2Y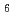 受容体活性化を介して放射線抵抗性が誘導されている可能性が示唆された。さらに新規放射線増感剤としてP2Y
受容体活性化を介して放射線抵抗性が誘導されている可能性が示唆された。さらに新規放射線増感剤としてP2Y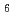 受容体阻害薬が有用である可能性が示された。
受容体阻害薬が有用である可能性が示された。