Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 Br-
Br- -methyl-phenylalanine for tumor PET imaging
-methyl-phenylalanine for tumor PET imaging花岡 宏史*; 大島 康宏; 鈴木 結利花*; 山口 藍子*; 渡辺 茂樹; 上原 知也*; 永森 收志*; 金井 好克*; 石岡 典子; 対馬 義人*; et al.
Journal of Nuclear Medicine, 56(5), p.791 - 797, 2015/05
被引用回数:18 パーセンタイル:62.62(Radiology, Nuclear Medicine & Medical Imaging)Radiolabeled amino acids are superior PET tracers for imaging of malignant tumors, and amino acids labeled with  Br, an attractive positron emitter due to its relatively long half-life (t
Br, an attractive positron emitter due to its relatively long half-life (t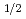 =16.2 h), could potentially be widely usable tumor imaging tracer. In this study, in consideration of stability and tumor specificity, 2-
=16.2 h), could potentially be widely usable tumor imaging tracer. In this study, in consideration of stability and tumor specificity, 2- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (2-
-methyl-L-phenylalanine (2- Br-BAMP) and 4-
Br-BAMP) and 4- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (4-
-methyl-L-phenylalanine (4- Br-BAMP) were designed and their potential as a tumor imaging agent was evaluated. No-carrier-added
Br-BAMP) were designed and their potential as a tumor imaging agent was evaluated. No-carrier-added  Br and
Br and  Br, the latter of which is suitable radiobromine for basic studies due to its longer half-life (t
Br, the latter of which is suitable radiobromine for basic studies due to its longer half-life (t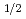 = 57.1 h), were produced. Both
= 57.1 h), were produced. Both  Br-BAMPs were stable in the plasma and in the murine body. In biodistribution studies, 2-
Br-BAMPs were stable in the plasma and in the murine body. In biodistribution studies, 2- Br-BAMP showed more rapid blood clearance and lower renal accumulation than did 4-
Br-BAMP showed more rapid blood clearance and lower renal accumulation than did 4- Br-BAMP. More than 90% of injected radioactivity was excreted in the urine by 6 h post-injection of 2-
Br-BAMP. More than 90% of injected radioactivity was excreted in the urine by 6 h post-injection of 2- Br-BAMP. High tumor accumulation of 2-
Br-BAMP. High tumor accumulation of 2- Br-BAMP was observed in tumor-bearing mice and PET imaging with 2-
Br-BAMP was observed in tumor-bearing mice and PET imaging with 2- Br-BAMP enabled clear visualization of the tumor. These findings suggest that 2-
Br-BAMP enabled clear visualization of the tumor. These findings suggest that 2- Br-BAMP would constitute a potential new PET tracer for tumor imaging and may eventually enable the wider use of amino acid tracers.
Br-BAMP would constitute a potential new PET tracer for tumor imaging and may eventually enable the wider use of amino acid tracers.
山崎 千里*; 村上 勝彦*; 藤井 康之*; 佐藤 慶治*; 原田 えりみ*; 武田 淳一*; 谷家 貴之*; 坂手 龍一*; 喜久川 真吾*; 嶋田 誠*; et al.
Nucleic Acids Research, 36(Database), p.D793 - D799, 2008/01
被引用回数:52 パーセンタイル:71.25(Biochemistry & Molecular Biology)ヒトゲノム解析のために、転写産物データベースを構築した。34057個のタンパク質コード領域と、642個のタンパク質をコードしていないRNAを見いだすことができた。
茅根 俊平*; 花岡 泰*; 徳弘 晃二*; 中坪 弘一*; 天野 正之*; 長谷 純宏; 田中 淳; 鳴海 一成
JAEA-Review 2006-042, JAEA Takasaki Annual Report 2005, P. 90, 2007/02
種間交雑によって育成されたハイブリッドスターチスは、おもに添え花として利用されている。本研究では、花が紫色のリモニウム系ハイブリッドスターチス「ムーンライト」の花色の幅を広げることを目的とした。無菌的に培養した「ムーンライト」の多芽体に、炭素イオンあるいはヘリウムイオンを照射した。照射後、新しい発根培地に移植し、移植1か月後に調査を行った。発根している培養体の順化を行い、順化2か月後にパイプハウスに定植し、開花検定を行った。炭素イオンでの適正線量は4Gy付近、ヘリウムイオンでの適正線量は10Gy付近であると推察されたが、花色や生育特性に関する変異個体は、現在のところ認められていない。供試個体数を増やし、供試試料の大きさや照射条件などを再検討することが必要と考えられた。
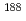 Re]Organorhenium-labeled antibody fragments with renal enzyme-cleavable linkage for low renal radioactivity levels
Re]Organorhenium-labeled antibody fragments with renal enzyme-cleavable linkage for low renal radioactivity levels上原 知也*; 小池 美穂*; 中田 英夫*; 花岡 宏史*; 飯田 靖彦*; 橋本 和幸; 秋澤 宏行*; 遠藤 啓吾*; 荒野 泰*
Bioconjugate Chemistry, 18(1), p.190 - 198, 2007/01
被引用回数:20 パーセンタイル:55.24(Biochemical Research Methods)抗体を標識母体とする薬剤は、その緩やかな血液クリアランスのため骨髄障害が広汎な応用を妨げる。標識母体を低分子化抗体(Fab)やペプチドに変換することで骨髄障害は解消されるが、腎臓への放射能滞留による腎障害が問題とされる。本研究では、腎臓刷子縁膜酵素の作用で標識Fabから尿排泄性の放射性代謝物を遊離する放射性レニウム標識薬剤を新規開発し、腎障害の解消を検討した。シクロペンタジエニルトリカルボニルレニウム(CpTR)をRe標識試薬の基本構造に選択し、CpTRにカルボン酸とグリシンを結合したCpTR-Glyの体内動態を検討した。その結果、CpTR-Glyは、マウス血清中で安定であること,血漿蛋白との結合が少ないことを明らかにした。また、CpTR-Glyをマウスに投与したとき、いずれの臓器にも滞留することなく、腎臓から速やかに尿中へと排泄されることを認めた。次に腎臓刷子縁膜酵素の作用でCpTR-GlyをFabから選択的に遊離するアミノ酸配列(マレイミド基)を導入した新規薬剤([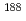 Re]CpTR-GK-Fab)を設計・合成し、マウス体内放射能動態を検討した。その結果、[
Re]CpTR-GK-Fab)を設計・合成し、マウス体内放射能動態を検討した。その結果、[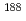 Re]CpTR-GK-Fabは、尿排泄性の放射性代謝物[
Re]CpTR-GK-Fabは、尿排泄性の放射性代謝物[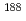 Re]CpTR-Glyを遊離して、腎臓への放射能集積を投与早期から大きく低減することを認めた。以上より、刷子縁膜酵素を利用した標識薬剤の設計は、金属RI標識低分子化抗体の腎臓への放射能集積の低減に有用であることを明らかにした。
Re]CpTR-Glyを遊離して、腎臓への放射能集積を投与早期から大きく低減することを認めた。以上より、刷子縁膜酵素を利用した標識薬剤の設計は、金属RI標識低分子化抗体の腎臓への放射能集積の低減に有用であることを明らかにした。
Mehnati, P.*; 森本 茂子*; 谷田貝 文夫*; 古澤 佳也*; 小林 泰彦; 和田 成一; 金井 達明*; 花岡 文雄*; 佐々木 弘*
Journal of Radiation Research, 46(3), p.343 - 350, 2005/09
被引用回数:31 パーセンタイル:63.87(Biology)イオン照射における生物学的効果比(RBE)はLET値とともに増加するが、非常に高いLET領域では逆に減少に転ずる。この現象を説明するため、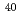 Arあるいは
Arあるいは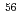 FeイオンビームをCHO細胞に照射し、試料中に混在する非ヒット細胞の割合と、ヒット細胞が分裂を経ずに死に至る間期死の頻度に注目して、照射後の細胞群を長時間に渡って追跡観察した。全細胞中の約20%が非ヒットであり、約10%が照射後も生残し、約70%が分裂死又は間期死を示した。分裂死及び間期死のRBEはLET=200keV/
FeイオンビームをCHO細胞に照射し、試料中に混在する非ヒット細胞の割合と、ヒット細胞が分裂を経ずに死に至る間期死の頻度に注目して、照射後の細胞群を長時間に渡って追跡観察した。全細胞中の約20%が非ヒットであり、約10%が照射後も生残し、約70%が分裂死又は間期死を示した。分裂死及び間期死のRBEはLET=200keV/ mあたりではほぼ同じで、30%生残線量では死細胞の約10%が間期死の経路を辿る。この率はLETによって異なり、2000keV/
mあたりではほぼ同じで、30%生残線量では死細胞の約10%が間期死の経路を辿る。この率はLETによって異なり、2000keV/ mの
mの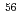 Feイオンでは15%に達するがX線では3%以下であった。しかし、1%生残線量の
Feイオンでは15%に達するがX線では3%以下であった。しかし、1%生残線量の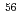 Feイオンで照射された後も、67%が分裂死を示し、33%の間期死を凌駕していた。これらの結果から、間期死は高LET放射線被曝に特異的な細胞死の様相であり、細胞レベルのオーバーキル効果の現れではないことが示唆された。
Feイオンで照射された後も、67%が分裂死を示し、33%の間期死を凌駕していた。これらの結果から、間期死は高LET放射線被曝に特異的な細胞死の様相であり、細胞レベルのオーバーキル効果の現れではないことが示唆された。
小川 数馬*; 向 高弘*; 荒野 泰*; 小野 正博*; 花岡 宏史*; 石野 誠悟*; 橋本 和幸; 西村 洋*; 佐治 英郎*
Bioconjugate Chemistry, 16(4), p.751 - 757, 2005/07
被引用回数:62 パーセンタイル:86.86(Biochemical Research Methods)患者のQOL(生活の質)の向上を目指した癌性骨転移の疼痛緩和薬剤として、ビスホスホネート化合物の一つであるHEDPに 線を放出する
線を放出する Reを標識した
Reを標識した Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への高い集積などが問題となっている。これはおもに、
Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への高い集積などが問題となっている。これはおもに、 Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、二官能性放射性医薬品の概念に基づき、安定な
Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、二官能性放射性医薬品の概念に基づき、安定な Re単核錯体である
Re単核錯体である Re-MAG3(メルカプトアセチルトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤
Re-MAG3(メルカプトアセチルトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤 Re-MAG3-HBPを設計・合成し、その特性を調べた。その結果、MAG3-HBPと
Re-MAG3-HBPを設計・合成し、その特性を調べた。その結果、MAG3-HBPと Re標識クエン酸の配位子置換反応により、
Re標識クエン酸の配位子置換反応により、 Re-MAG3-HBPを95%以上の放射化学的純度で合成できた。また、本化合物は、リン酸緩衝溶液において、24時間後でも分解は観察されず、
Re-MAG3-HBPを95%以上の放射化学的純度で合成できた。また、本化合物は、リン酸緩衝溶液において、24時間後でも分解は観察されず、 Re-HEDPに比べてかなり安定であった。さらに、動物実験の結果、
Re-HEDPに比べてかなり安定であった。さらに、動物実験の結果、 Re-MAG3-HBPは、
Re-MAG3-HBPは、 Re-HEDPに比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることが明らかになった。
Re-HEDPに比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることが明らかになった。
小川 数馬*; 向 高弘*; 荒野 泰*; 花岡 宏史*; 橋本 和幸; 西村 洋*; 佐治 英郎*
Journal of Labelled Compounds and Radiopharmaceuticals, 47(11), p.753 - 761, 2004/11
被引用回数:29 パーセンタイル:61.65(Biochemical Research Methods)癌性骨転移の疼痛緩和薬剤として、ビスホスホネート化合物の一つであるHEDPに 線を放出する
線を放出する Reを標識した
Reを標識した Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への集積などが問題となっている。これはおもに、
Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への集積などが問題となっている。これはおもに、 Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、安定な
Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、安定な Re単核錯体である
Re単核錯体である Re-MAMA(モノアミンモノアミドジチオール)をビスホスホネート骨格を持つ化合物に導入した新規薬剤
Re-MAMA(モノアミンモノアミドジチオール)をビスホスホネート骨格を持つ化合物に導入した新規薬剤 Re-MAMA-BPを設計・合成し、その化学的挙動を調べた。その結果、
Re-MAMA-BPを設計・合成し、その化学的挙動を調べた。その結果、 Re標識グルコヘプトン酸の配位子置換反応により、
Re標識グルコヘプトン酸の配位子置換反応により、 Re-MAMA-BPを標識率32.0
Re-MAMA-BPを標識率32.0 4.1%で合成することができた。また、本化合物は、緩衝液中(pH7.0)では、
4.1%で合成することができた。また、本化合物は、緩衝液中(pH7.0)では、 Re-HEDPに比べてかなり安定であった。したがって、
Re-HEDPに比べてかなり安定であった。したがって、 Re-MAMA-BPは、癌性骨転移の疼痛緩和薬剤として優れた化学的特性を有していることが明らかになった。
Re-MAMA-BPは、癌性骨転移の疼痛緩和薬剤として優れた化学的特性を有していることが明らかになった。
茅根 俊平*; 花岡 泰*; 徳弘 晃二*; 中坪 弘一*; 天野 正之*; 長谷 純宏; 田中 淳; 鳴海 一成
no journal, ,
種間交雑によって育成されたハイブリッドスターチスは、おもに添え花として利用されている。本研究では、花が紫色のリモニウム系ハイブリッドスターチス「ムーンライト」の花色の幅を広げることを目的とした。無菌的に培養した「ムーンライト」の多芽体に、炭素イオンあるいはヘリウムイオンを照射した。照射後、新しい発根培地に移植し、移植1か月後に調査を行った。発根している培養体の順化を行い、順化2か月後にパイプハウスに定植し、開花検定を行った。炭素イオンでの適正線量は4Gy付近、ヘリウムイオンでの適正線量は10Gy付近であると推察された。炭素イオンを照射した152個体、ヘリウムイオンを照射した207個体の開花検定を行った結果、花色変化などの明確な変異個体は認められなかった。ヘリウムイオンを照射した中から従来に比べて切り花本数の多い1個体が見いだされた。
 Br標識抗体フラグメントの開発
Br標識抗体フラグメントの開発花岡 宏史*; 渡邉 茂樹; 渡辺 智; 大島 康宏; 上原 知也*; 秋澤 宏行*; 飯田 靖彦*; 石岡 典子; 荒野 泰*; 遠藤 啓吾*
no journal, ,
ポジトロン放出核種の一つである Brは半減期が16.1hと比較的長いことから、集積に時間を要するFab等の抗体フラグメントの標識にも利用できる。しかし
Brは半減期が16.1hと比較的長いことから、集積に時間を要するFab等の抗体フラグメントの標識にも利用できる。しかし Br標識Fabを生体内に投与した場合、腎臓への非特異的集積やFabより遊離したBrの血中滞留など、非標的臓器での放射能滞留が問題となる。そこで本研究では、
Br標識Fabを生体内に投与した場合、腎臓への非特異的集積やFabより遊離したBrの血中滞留など、非標的臓器での放射能滞留が問題となる。そこで本研究では、 Br標識Fabの非標的臓器への放射能集積低減を目的として、生体内で安定かつ腎放射能集積を大きく低減することが可能な代謝性スペーサーhippuryl-N-maleoyl-L-lysine(HML)を利用した
Br標識Fabの非標的臓器への放射能集積低減を目的として、生体内で安定かつ腎放射能集積を大きく低減することが可能な代謝性スペーサーhippuryl-N-maleoyl-L-lysine(HML)を利用した Br標識Fabを合成し、非標的組織における放射能集積について評価した。Br-HML-Fabを作製し、ノーマルマウスにおける体内動態を検討したところ、Br-HML-Fabは直接標識体と比較して血液から速やかにクリアランスされ、また代謝性スペーサーを含まないBr安息香酸標識体と比較して腎臓への放射能集積が大きく低減した。以上より、Br-HML-Fabは非標的臓器における放射能集積が低く、イメージング剤として有用である可能性が示された。
Br標識Fabを合成し、非標的組織における放射能集積について評価した。Br-HML-Fabを作製し、ノーマルマウスにおける体内動態を検討したところ、Br-HML-Fabは直接標識体と比較して血液から速やかにクリアランスされ、また代謝性スペーサーを含まないBr安息香酸標識体と比較して腎臓への放射能集積が大きく低減した。以上より、Br-HML-Fabは非標的臓器における放射能集積が低く、イメージング剤として有用である可能性が示された。
 Br標識アミノ酸の開発
Br標識アミノ酸の開発花岡 宏史*; 渡邉 茂樹; 富永 英之*; 大島 康宏; 渡辺 智; 山田 圭一*; 荒野 泰*; 石岡 典子; 遠藤 啓吾*
no journal, ,
近年、がんに対する特異性が高いPET薬剤として、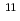 Cや
Cや Fで標識したアミノ酸誘導体が開発され、臨床応用されるようになってきた。しかしながら
Fで標識したアミノ酸誘導体が開発され、臨床応用されるようになってきた。しかしながら Cや
Cや Fは半減期が非常に短いため、それぞれの病院で製造・合成する必要があり、限られた施設でしか使えないのが現状である。一方、
Fは半減期が非常に短いため、それぞれの病院で製造・合成する必要があり、限られた施設でしか使えないのが現状である。一方、 Brは、半減期が16.1時間とポジトロン放出核種としては比較的長く、またハロゲン核種であるため母体化合物との結合にキレート剤等が必要ないことから、アミノ酸のような低分子化合物に対しても応用可能である。そこで本研究では、広く臨床使用することが可能な、新規がん診断用PETイメージング薬剤として
Brは、半減期が16.1時間とポジトロン放出核種としては比較的長く、またハロゲン核種であるため母体化合物との結合にキレート剤等が必要ないことから、アミノ酸のような低分子化合物に対しても応用可能である。そこで本研究では、広く臨床使用することが可能な、新規がん診断用PETイメージング薬剤として Br標識アミノ酸誘導体の開発を計画した。基礎検討には半減期が長い放射性臭素である
Br標識アミノ酸誘導体の開発を計画した。基礎検討には半減期が長い放射性臭素である Br(半減期57時間)を用いて行うこととした。Br標識アミノ酸としては、
Br(半減期57時間)を用いて行うこととした。Br標識アミノ酸としては、 メチルフェニルアラニン(
メチルフェニルアラニン( -Me-Phe)のパラ位にBrを導入したBr-
-Me-Phe)のパラ位にBrを導入したBr- -Me-Pheを設計した。
-Me-Pheを設計した。 Br-
Br- -Me-Pheは標識率25-40%で合成することができた。
-Me-Pheは標識率25-40%で合成することができた。 Br-
Br- -Me-Pheを担癌マウスに投与したところ、腫瘍への高い集積性を示し、投与3時間後の腫瘍対血液比は3.94、腫瘍対筋肉比は3.95であった。
-Me-Pheを担癌マウスに投与したところ、腫瘍への高い集積性を示し、投与3時間後の腫瘍対血液比は3.94、腫瘍対筋肉比は3.95であった。 Br-
Br- -Me-Pheを担癌マウスに投与し、6時間後にPET撮像を行ったところ、腫瘍を明瞭に描出することができた。以上の結果から、
-Me-Pheを担癌マウスに投与し、6時間後にPET撮像を行ったところ、腫瘍を明瞭に描出することができた。以上の結果から、 Br-
Br- -Me-Pheの新規がんイメージング薬剤としての有用性が示唆された。
-Me-Pheの新規がんイメージング薬剤としての有用性が示唆された。
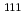 In標識馬尿酸誘導体の合成と
In標識馬尿酸誘導体の合成と 評価
評価鈴木 博元; 金井 彩香*; 上原 知也*; 花岡 宏史*; 荒野 泰*
no journal, ,
Radiolabeled antibody fragments show rapid elimination rate from blood, which can improve bone marrow toxicities of radiolabeled intact IgG. However, high and persistent localization in kidney is observed, which impairs diagnostic accuracy and therapeutic effectiveness. Brush border strategy succeeded to reduce renal radioactivity by using the radioiodine labeled antibody fragment in which a cleavable peptide linker is introduced. In the strategy, the radiometabolite is liberated by the action of renal brush border enzymes before incorporating into renal cells, and excreted into urine. In order to apply this molecular design to radiometals such as 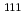 In and
In and 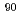 Y, the radiometabolite with high urinary excretion, which includes a radiometal-chelating moiety is required. In this study, we synthesized and evaluated a hippuric acid derivative, Bn-CHX-A"-DTPA-Gly labeled with
Y, the radiometabolite with high urinary excretion, which includes a radiometal-chelating moiety is required. In this study, we synthesized and evaluated a hippuric acid derivative, Bn-CHX-A"-DTPA-Gly labeled with 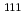 In as a radiometabolite.
In as a radiometabolite.
 At]astato-
At]astato- -methyl-L-phenylalanine (2-AAMP) as a novel radiopharmaceutical for internal radiotherapy
-methyl-L-phenylalanine (2-AAMP) as a novel radiopharmaceutical for internal radiotherapy大島 康宏; 鈴木 博元*; 花岡 宏史*; 渡辺 茂樹; 渡辺 智; 渡邉 直行*; 対馬 義人*; 遠藤 啓吾*; 荒野 泰*; 石岡 典子
no journal, ,
In this study, we newly synthesized 2-[ At]astato-
At]astato- -methyl-Lphenylalanine (2-AAMP) and investigated its possibility as a novel radiopharmaceutical for the internal radiotherapy.
-methyl-Lphenylalanine (2-AAMP) and investigated its possibility as a novel radiopharmaceutical for the internal radiotherapy.  At was produced via the
At was produced via the 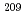 Bi(
Bi( , 2n)
, 2n) At reaction and separated from the Bi target by a dry-distillation technique. For 2-AAMP synthesis, 2-trimethylstannyl-
At reaction and separated from the Bi target by a dry-distillation technique. For 2-AAMP synthesis, 2-trimethylstannyl-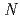 -trifluoroacetyl-
-trifluoroacetyl- -methyl-L-phenylalanine methyl ester was synthesized as a precursor and radioastatinated in the presence of
-methyl-L-phenylalanine methyl ester was synthesized as a precursor and radioastatinated in the presence of 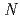 -chlorosuccinimide. The following deprotection reaction gave 2-AAMP in 18% yield. 2-AAMP was rapidly taken up into SKOV3 cells expressing L-type amino acid transporter 1 (LAT1) which is highly and specifically expressed in tumor cells. The uptake of 2-AAMP was significantly inhibited by not only the treatment with L-amino acids which are the substrates of LAT1, but also 2-amino-bicyclo[2,2,1]heptane-2-carboxylic acid, an inhibitor of LAT, indicating that 2-AAMP could be taken up through LAT1. Colony formation of SKOV3 was decreased to approx. 46% of control by the treatment with 2-AAMP for 22 h at 25 kBq/ml (initial concentration of radioactivity). These results suggest that 2-AAMP might be selectively accumulated in tumor and suppress growth of cancer. At present, stability, biodistribution and anti-tumor activity of 2-AAMP are under investigation.
-chlorosuccinimide. The following deprotection reaction gave 2-AAMP in 18% yield. 2-AAMP was rapidly taken up into SKOV3 cells expressing L-type amino acid transporter 1 (LAT1) which is highly and specifically expressed in tumor cells. The uptake of 2-AAMP was significantly inhibited by not only the treatment with L-amino acids which are the substrates of LAT1, but also 2-amino-bicyclo[2,2,1]heptane-2-carboxylic acid, an inhibitor of LAT, indicating that 2-AAMP could be taken up through LAT1. Colony formation of SKOV3 was decreased to approx. 46% of control by the treatment with 2-AAMP for 22 h at 25 kBq/ml (initial concentration of radioactivity). These results suggest that 2-AAMP might be selectively accumulated in tumor and suppress growth of cancer. At present, stability, biodistribution and anti-tumor activity of 2-AAMP are under investigation.
 Br標識アミノ酸2-
Br標識アミノ酸2- Br-bromo-
Br-bromo- -methyl-L-phenylalanineの開発
-methyl-L-phenylalanineの開発大島 康宏; 花岡 宏史*; 鈴木 結利花*; 山口 藍子*; 渡辺 茂樹; 上原 知也*; 永森 收志*; 金井 好克*; 石岡 典子; 対馬 義人*; et al.
no journal, ,
本研究では、より生体内安定性の高い Br標識アミノ酸として、新たに2-
Br標識アミノ酸として、新たに2- Br-bromo-
Br-bromo- -methyl-L-phenylalanine (2-
-methyl-L-phenylalanine (2- Br-BAMP)を合成し、新規PETイメージング薬としての有用性について検討した。放射性Br(
Br-BAMP)を合成し、新規PETイメージング薬としての有用性について検討した。放射性Br( Br及び
Br及び Br)はセレン化銅ターゲットに対してプロトンビーム(20MeV)を照射することで製造した。
Br)はセレン化銅ターゲットに対してプロトンビーム(20MeV)を照射することで製造した。 Brは半減期16.2時間の陽電子放出核種であることからPETイメージングに使用し、
Brは半減期16.2時間の陽電子放出核種であることからPETイメージングに使用し、 Brは半減期57.1時間の
Brは半減期57.1時間の 線放出核種であることから基礎検討に使用した。酸化剤存在下において、放射性Brと標識前駆体(2-trimethylstannyl-N-trifluoroacetyl-
線放出核種であることから基礎検討に使用した。酸化剤存在下において、放射性Brと標識前駆体(2-trimethylstannyl-N-trifluoroacetyl- -methyl-L-phenylalanine methyl ester)を反応させ、2-
-methyl-L-phenylalanine methyl ester)を反応させ、2- Br-BAMP及び2-
Br-BAMP及び2- Br-BAMPを合成した。HPLC分析の結果、標識率52.6
Br-BAMPを合成した。HPLC分析の結果、標識率52.6 11.9%、放射化学的純度95%以上で2-
11.9%、放射化学的純度95%以上で2- Br-BAMPの合成が可能であった。血清及びマウス体内における2-
Br-BAMPの合成が可能であった。血清及びマウス体内における2- Br-BAMPの分解はほとんど認められず、非常に高い安定性を示した。体内分布では、2-
Br-BAMPの分解はほとんど認められず、非常に高い安定性を示した。体内分布では、2- Br-BAMPは癌へ高度に集積する一方、血中からの消失は早く、投与放射能の90%以上が6時間以内に尿中に排泄され、正常臓器へ非常に低い集積を示した。さらに2-
Br-BAMPは癌へ高度に集積する一方、血中からの消失は早く、投与放射能の90%以上が6時間以内に尿中に排泄され、正常臓器へ非常に低い集積を示した。さらに2- Br-BAMPを用いてPET撮像を行った結果、癌を明瞭にイメージングすることができた。これらの結果より、2-
Br-BAMPを用いてPET撮像を行った結果、癌を明瞭にイメージングすることができた。これらの結果より、2- Br-BAMPの新規PETイメージング薬としての有用性が示唆された。
Br-BAMPの新規PETイメージング薬としての有用性が示唆された。
 At標識
At標識 -methyl-L-phenylalanineの合成とその基礎的評価
-methyl-L-phenylalanineの合成とその基礎的評価鈴木 博元*; 大島 康宏; 花岡 宏史*; 渡辺 茂樹; 渡辺 智; 佐々木 一郎; 坂下 哲哉; 荒野 泰*; 石岡 典子
no journal, ,
 Atは
Atは 線を放出する放射性ハロゲンであり、内用放射線治療への応用が期待されている。
線を放出する放射性ハロゲンであり、内用放射線治療への応用が期待されている。 Atは他のハロゲンと化学的性質が類似するため、従来の放射性ハロゲン標識薬剤の設計を応用できる可能性がある。[
Atは他のハロゲンと化学的性質が類似するため、従来の放射性ハロゲン標識薬剤の設計を応用できる可能性がある。[ Br]2-Bromo-
Br]2-Bromo- -methyl-L-phenylalanine (2-BAMP)はLAT1選択的な高い腫瘍取り込みと優れた体内動態を示す。そこで、2-BAMPの薬剤設計に基づき、
-methyl-L-phenylalanine (2-BAMP)はLAT1選択的な高い腫瘍取り込みと優れた体内動態を示す。そこで、2-BAMPの薬剤設計に基づき、 Atを導入した[
Atを導入した[ At]2-astato-
At]2-astato- -methyl-L-phenylalanine (2-AAMP)を合成し、化合物としての特徴を2-BAMPと比較検討した。
-methyl-L-phenylalanine (2-AAMP)を合成し、化合物としての特徴を2-BAMPと比較検討した。 Atは
Atは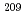 Bi(
Bi( ,2n)
,2n) At反応により製造し、乾式蒸留法により精製した。NCS存在下において、
At反応により製造し、乾式蒸留法により精製した。NCS存在下において、 Atをトリメチルスズ標識前駆体と反応させ、
Atをトリメチルスズ標識前駆体と反応させ、 At標識体を取得し、NaOHを用いた脱保護の後、中和、HPLC精製により2-AAMPを得た。得られた2-AAMPについて、血漿中安定性および正常マウスにおける体内分布を検討した。2-AAMPは放射化学的収率
At標識体を取得し、NaOHを用いた脱保護の後、中和、HPLC精製により2-AAMPを得た。得られた2-AAMPについて、血漿中安定性および正常マウスにおける体内分布を検討した。2-AAMPは放射化学的収率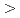 90%で合成でき、血漿中での培養6時間後においても80%以上が未変化体として存在した。体内分布実験では、投与1時間後の胃への集積が1.16%IDであった。同様の集積は2-BAMPでは観察されておらず、2-AAMPの生体内安定性は2-BAMPに劣ることが示唆された。一方、2-AAMPは2-BAMP同様、速やかな体内クリアランスを示し、優れた体内動態を示すことが明らかとなった。今後、担癌モデルマウスにおける腫瘍集積性を検討する予定である。
90%で合成でき、血漿中での培養6時間後においても80%以上が未変化体として存在した。体内分布実験では、投与1時間後の胃への集積が1.16%IDであった。同様の集積は2-BAMPでは観察されておらず、2-AAMPの生体内安定性は2-BAMPに劣ることが示唆された。一方、2-AAMPは2-BAMP同様、速やかな体内クリアランスを示し、優れた体内動態を示すことが明らかとなった。今後、担癌モデルマウスにおける腫瘍集積性を検討する予定である。