Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -glucosyltransferase from
-glucosyltransferase from 
廣本 武史; 本庄 栄二郎*; 野田 尚信*; 玉田 太郎; 数馬 恒平*; 鈴木 正彦*; Blaber, M.; 黒木 良太
Protein Science, 24(3), p.395 - 407, 2015/03
被引用回数:62 パーセンタイル:88.89(Biochemistry & Molecular Biology)チョウマメの花弁に含まれるUDP-glucose: anthocyanidin 3- -glucosyltransferase(UGT78K6)は、UDP-glucoseを糖供与体とし、青色色素の基本骨格をなすデルフィニジンへの糖転移を触媒する酵素である。本酵素は、「フラボノール」に類似した化学構造を有するにもかかわらず、デルフィニジンなど「アントシアニジン」特異的な糖転移活性を示す。その糖受容体認識に関わる構造基盤を明らかにするため、UGT78K6単独の立体構造ならびに各糖受容体(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した複合体の立体構造をX線結晶構造解析により決定した。今回の研究で見出された糖受容体の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来
-glucosyltransferase(UGT78K6)は、UDP-glucoseを糖供与体とし、青色色素の基本骨格をなすデルフィニジンへの糖転移を触媒する酵素である。本酵素は、「フラボノール」に類似した化学構造を有するにもかかわらず、デルフィニジンなど「アントシアニジン」特異的な糖転移活性を示す。その糖受容体認識に関わる構造基盤を明らかにするため、UGT78K6単独の立体構造ならびに各糖受容体(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した複合体の立体構造をX線結晶構造解析により決定した。今回の研究で見出された糖受容体の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来 GT1)とケンフェロールとの結合様式とは全く異なるものであり、発色の異なる糖受容体「アントシアニジン」と「フラボノール」をどのように識別しているのか、その分子メカニズムの解明を可能とした。今後、得られた構造情報を基に糖受容体との相互作用部位を改変することにより、色味の異なる色素化合物の合成あるいは医薬品候補分子の合成を可能にするものと期待される。
GT1)とケンフェロールとの結合様式とは全く異なるものであり、発色の異なる糖受容体「アントシアニジン」と「フラボノール」をどのように識別しているのか、その分子メカニズムの解明を可能とした。今後、得られた構造情報を基に糖受容体との相互作用部位を改変することにより、色味の異なる色素化合物の合成あるいは医薬品候補分子の合成を可能にするものと期待される。
 -glucosyltransferase from
-glucosyltransferase from 
廣本 武史; 本庄 栄二郎*; 玉田 太郎; 野田 尚信*; 数馬 恒平*; 鈴木 正彦*; 黒木 良太
Journal of Synchrotron Radiation, 20(6), p.894 - 898, 2013/11
被引用回数:38 パーセンタイル:86.36(Instruments & Instrumentation)チョウマメの花弁には、テルナチンと呼ばれるポリアシル化アントシアニンが含まれている。その生合成の最初の段階を担うのがUDP-グルコース:アントシアニジン3- -グルコシルトランスフェラーゼ(
-グルコシルトランスフェラーゼ( 3GT-A)であり、UDP-グルコースを糖供与体とし、糖受容体であるアントシアニジン類への糖転移反応を触媒する。ここでは
3GT-A)であり、UDP-グルコースを糖供与体とし、糖受容体であるアントシアニジン類への糖転移反応を触媒する。ここでは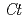 3GT-Aの構造機能相関を明らかにするため、
3GT-Aの構造機能相関を明らかにするため、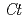 3GT-Aの大腸菌組換え体を調製し、その立体構造をX線結晶構造解析により1.85
3GT-Aの大腸菌組換え体を調製し、その立体構造をX線結晶構造解析により1.85 分解能で決定した。その全体構造は、2つのRossmann-like
分解能で決定した。その全体構造は、2つのRossmann-like  /
/ /
/ ドメインから成るGT-Bフォールドを有しており、また2つのドメイン間に形成されたクレフトには、糖供与体(UDP-Glc)および糖受容体を結合するキャビティが存在していた。既に報告されている赤ブドウ由来フラボノイド3-
ドメインから成るGT-Bフォールドを有しており、また2つのドメイン間に形成されたクレフトには、糖供与体(UDP-Glc)および糖受容体を結合するキャビティが存在していた。既に報告されている赤ブドウ由来フラボノイド3-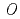 -グリコシルトランスフェラーゼ(
-グリコシルトランスフェラーゼ(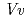 GT1)との構造比較より、糖受容体であるケンフェロールの結合に関与するアミノ酸残基が
GT1)との構造比較より、糖受容体であるケンフェロールの結合に関与するアミノ酸残基が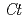 3GT-Aにおいて有意に置換されていることが明らかとなった。これらの知見は、両酵素の糖受容体特異性の差別化を理解する上で重要と考えられる。
3GT-Aにおいて有意に置換されていることが明らかとなった。これらの知見は、両酵素の糖受容体特異性の差別化を理解する上で重要と考えられる。
伊藤 栄近*; 鈴木 章一*; 金地 佐千子*; 白石 裕士*; 太田 昭一郎*; 有馬 和彦*; 田中 剛*; 玉田 太郎; 本庄 栄二郎*; Garcia, K. C.*; et al.
Journal of Biological Chemistry, 284(36), p.24289 - 24296, 2009/09
被引用回数:24 パーセンタイル:46.81(Biochemistry & Molecular Biology)IL-4とIL-13はともにIL-4受容体 鎖とIL-13受容体
鎖とIL-13受容体 -1鎖(IL-13R
-1鎖(IL-13R 1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R
1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R 1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の
1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
安達 基泰; 大原 高志; 栗原 和男; 玉田 太郎; 本庄 栄二郎; 岡崎 伸生; 新井 栄揮; 正山 祥生; 木村 要*; 松村 浩由*; et al.
Proceedings of the National Academy of Sciences of the United States of America, 106(12), p.4641 - 4646, 2009/03
被引用回数:111 パーセンタイル:90.58(Multidisciplinary Sciences)本研究では、プロテアーゼとその医薬品候補分子との分子間相互作用を原子レベルで解明することを目的として、阻害剤との複合体の中性子結晶構造解析を実施した。タンパク質の中性子結晶構造解析を行うには、高品質な大型結晶作成のために大量のタンパク質試料が必要となる。本研究では、コドン配列を最適化した人工遺伝子を合成することで効率的な大腸菌発現系を構築し、プロテアーゼの大量調製系を確立した。そして逆相クロマトグラフィーを用いることで自己分解物を完全に除去した純度の高い試料を調製して結晶化を行った。得られた結晶を用いてJRR-3に設置しているBIX-4にて中性子回折データを収集した結果、1.9 の回折データを得ることができた。プログラムPHENIXにより中性子とX線の同時精密化を実施し、世界で初めてHIV-1プロテアーゼの中性子結晶構造解析に成功した。重水素原子の存在と位置を確認するためにオミットマップを作成したところ、顕著な2つのピークを得た。プロトン化された触媒残基及び阻害剤のヒドロキシル基の構造を水素原子を含めて実験で初めて明らかにすることができた。
の回折データを得ることができた。プログラムPHENIXにより中性子とX線の同時精密化を実施し、世界で初めてHIV-1プロテアーゼの中性子結晶構造解析に成功した。重水素原子の存在と位置を確認するためにオミットマップを作成したところ、顕著な2つのピークを得た。プロトン化された触媒残基及び阻害剤のヒドロキシル基の構造を水素原子を含めて実験で初めて明らかにすることができた。
 chain and interleukin-13 receptor
chain and interleukin-13 receptor  1 chain by a silkworm-baculovirus system
1 chain by a silkworm-baculovirus system本庄 栄二郎; 正山 祥生; 玉田 太郎; 重松 秀樹*; 畠中 孝彰*; 金地 佐千子*; 有馬 和彦*; 伊東 祐二*; 出原 賢治*; 黒木 良太
Protein Expression and Purification, 60(1), p.25 - 30, 2008/07
被引用回数:13 パーセンタイル:33.51(Biochemical Research Methods)インターロイキン-13に対する受容体はインターロイキン-13 1鎖及びインターロイキン-4
1鎖及びインターロイキン-4 鎖からなる。これらの相互作用を調べるため、IL-13受容体
鎖からなる。これらの相互作用を調べるため、IL-13受容体 1鎖及びIL-4受容体
1鎖及びIL-4受容体 鎖細胞外領域をコードするDNAをマウスIgGのFcと融合体としてカイコ/バキュロウイルス系で発現した。受容体はプロテインAカラムを用いて回収し、トロンビン消化でFcと切り離すことができた。ゲルろ過やSPR分析の結果、IL-13とIL-13受容体
鎖細胞外領域をコードするDNAをマウスIgGのFcと融合体としてカイコ/バキュロウイルス系で発現した。受容体はプロテインAカラムを用いて回収し、トロンビン消化でFcと切り離すことができた。ゲルろ過やSPR分析の結果、IL-13とIL-13受容体 1鎖複合体はIL-4受容体
1鎖複合体はIL-4受容体 と結合したが、IL-13やIL-13受容体
と結合したが、IL-13やIL-13受容体 1鎖単独でのIL-4受容体
1鎖単独でのIL-4受容体 との相互作用は見られなかった。これらの結果から、IL-13はIL-13受容体
との相互作用は見られなかった。これらの結果から、IL-13はIL-13受容体 1と相互作用し、さらにIL-4受容体
1と相互作用し、さらにIL-4受容体 と結合することが明らかとなった。
と結合することが明らかとなった。
本庄 栄二郎; 玉田 太郎; 安達 基泰; 黒木 良太; Meher, A.*; Blaber, M.*
Journal of Synchrotron Radiation, 15(3), p.285 - 287, 2008/05
被引用回数:5 パーセンタイル:29.64(Instruments & Instrumentation)われわれは薄板状にしか結晶化しないhaFGFの分子間接触部位を改善し結晶成長を制御することを試みている。haFGFのX線結晶構造から結晶学的に対称な位置関係にあるhaFGF分子の分子間接触部位にはGlu81の側鎖が近接して存在しており、この電荷の反発が分子間相互作用を乱している可能性が考えられた。このGlu81の側鎖が分子間相互作用に関与しているかどうかを調べるため、われわれはGlu81をAla, Val, Leu, Ser及びThrに置換したhaFGFの変異体を作成した。このGlu81の側鎖が分子間相互作用に関与しているかどうかを調べるため、われわれはGlu81をAla, Val, Leu, Ser及びThrに置換したhaFGFの変異体を作成した。それぞれの変異体について蟻酸を用いて結晶化を行ったところ、Ala, Val及びLeu変異体は野生型同様薄板状の結晶成長が見られたが、Ser及びThr変異体の結晶は野生型よりもより厚みが増していた。これらの変異体について1.5 分解能のX線構造を解いたところ分子間接触部位に存在するSerの水酸基が沈殿剤である蟻酸を介して水素結合を形成していることがわかった。このような分子間接触部位改変の試みは中性子結晶構造解析のための大型結晶育成に寄与すると考えられる。
分解能のX線構造を解いたところ分子間接触部位に存在するSerの水酸基が沈殿剤である蟻酸を介して水素結合を形成していることがわかった。このような分子間接触部位改変の試みは中性子結晶構造解析のための大型結晶育成に寄与すると考えられる。
本庄 栄二郎; 黒木 良太; 小堀 博史*; 高蔵 晃*; 矢幡 一英*; 曽根 岳史*; 今本 文男*; 森山 達哉*
タンパク質精製と取扱いのコツ, p.135 - 178, 2007/10
研究者にとって、タンパク質の精製や取り扱いは、その後の実験の成功を左右するといっても過言ではない重要なステップである。しかしタンパク質の扱い方には、生化学的なコツや知識が必要となり、特にタンパク質に慣れていない分子生物学者にとって、大きな課題となっている。そこで本書では、組換えタンパク質の発現・精製のポイントを紹介し、通常のプロトコールでは紹介されない、キットや機器選択や実験のコツなど、実践的なノウハウに焦点を絞って概説する。
山田 秀徳*; 玉田 太郎; 小坂 恵*; 宮田 幸平*; 藤木 伸哉*; 田納 優*; 守屋 雅之*; 山西 守*; 本庄 栄二郎; 多田 宏子*; et al.
Protein Science, 16(7), p.1389 - 1397, 2007/07
被引用回数:39 パーセンタイル:59.43(Biochemistry & Molecular Biology)タンパク質の結晶格子は分子表面同士の相互作用からなっている。結晶格子内へのタンパク質の導入のため、ロイシンジッパー様の疎水的な相互作用をヒト膵臓RNase1のへリックス2へ導入した。野生型ヒトRNase1の結晶化はまだ報告をされていないが、4残基のロイシンを導入したRNase1では複数の結晶化条件で結晶を得た。そのX線結晶構造をウシRNaseAの立体構造を用いて分子置換法により決定した。こうして決定されたヒトRNase1の立体構造は、ウシRNaseAの立体構造と大変似ており、導入したロイシン残基を介して2分子のRNase1が疎水的なパッキングしていた。ロイシン導入の効果をさらに検討するために、導入したロイシン残基の数を3残基,2残基と減らした変異体を調製し結晶化を行った。これらの場合もロイシン残基による疎水的なパッキングが形成されていた。一方、ロイシン残基をヒトRNase1の別のへリックス(へリックス3)に導入し、効果を検証した。その結果、4残基のロイシンを導入した変異体でも結晶化し、4分子のRNase1が導入したロイシン残基を介してパッキングをしていることがわかった。これらの結果は、適切なロイシン導入により分子内対称性が生じ、より効果的に結晶化を促進する可能性を示す。
玉田 太郎; 本庄 栄二郎; 黒木 良太
日本結晶学会誌, 48(6), p.429 - 435, 2006/12
ヒト顆粒球コロニー刺激因子(GCSF)とそのヒト受容体(GCSF-R)中のリガンド結合領域との複合体の活性構造を2.8 分解能で決定した。GCSF/GCSF-R複合体の組成比は2:2で、GCSF-R中Ig様ドメインとGCSFがたすき掛けすることにより二量体化していた。この結合様式はヒトGCSFとマウスGCSF-R(CRH)ドメイン複合体中の様式とは全く異なっていた。このIg様ドメインを介したGCSF-Rの二量体化はこれまでに報告されている熱力学的及び変異体解析の結果と相関性がある。
分解能で決定した。GCSF/GCSF-R複合体の組成比は2:2で、GCSF-R中Ig様ドメインとGCSFがたすき掛けすることにより二量体化していた。この結合様式はヒトGCSFとマウスGCSF-R(CRH)ドメイン複合体中の様式とは全く異なっていた。このIg様ドメインを介したGCSF-Rの二量体化はこれまでに報告されている熱力学的及び変異体解析の結果と相関性がある。
玉田 太郎; 本庄 栄二郎; 前田 宜丈*; 岡本 智之*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Proceedings of the National Academy of Sciences of the United States of America, 103(9), p.3135 - 3140, 2006/02
被引用回数:95 パーセンタイル:84.67(Multidisciplinary Sciences)ヒト顆粒球コロニー刺激因子(GCSF)とそのヒト受容体(GCSF-R)中のリガンド結合領域との複合体の活性構造を2.8 分解能で決定した。GCSF:GCSF-R複合体の組成比は2:2で、GCSF-R中のIg-likeドメインとGCSFがたすき掛けすることにより二量体化していた。この結合様式はヒトGCSFとマウスGCSF(CRHドメイン)複合体中の様式とは全く異なっており、インターロイキン6とその受容体であるgp130との活性複合体中で確認された様式と類似していた。このIg-likeドメインを介したGCSF-Rの二量体化はこれまでに報告されている熱力学的及び変異体解析の結果と相関性がある。
分解能で決定した。GCSF:GCSF-R複合体の組成比は2:2で、GCSF-R中のIg-likeドメインとGCSFがたすき掛けすることにより二量体化していた。この結合様式はヒトGCSFとマウスGCSF(CRHドメイン)複合体中の様式とは全く異なっており、インターロイキン6とその受容体であるgp130との活性複合体中で確認された様式と類似していた。このIg-likeドメインを介したGCSF-Rの二量体化はこれまでに報告されている熱力学的及び変異体解析の結果と相関性がある。
本庄 栄二郎; 玉田 太郎; 前田 宜丈*; 小柴 琢己*; 松倉 康子*; 岡本 智之*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Acta Crystallographica Section F, 61(8), p.788 - 790, 2005/08
被引用回数:7 パーセンタイル:55.15(Biochemical Research Methods)顆粒球刺激因子(GCSF)受容体は顆粒球前駆体の分化や増殖を調節する刺激を細胞内へ伝える。その受容体のリガンド結合部位とGCSFの2:2複合体の結晶化を行った。結晶は1.0Mギ酸ナトリウムを含む0.1M酢酸緩衝液(pH4.6)の条件で結晶化した。空間群は 4
4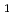 2
2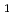 2(もしくは
2(もしくは 4
4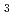 2
2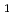 2)で、セル長は
2)で、セル長は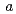 =
=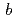 =110.1
=110.1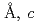 =331.8
=331.8 であった。しかしながら5
であった。しかしながら5 以上の回折データが収集できなかったことから、受容体を陰イオン交換クロマトグラフィーで精製し、再度結晶化を試みた。その結果、3
以上の回折データが収集できなかったことから、受容体を陰イオン交換クロマトグラフィーで精製し、再度結晶化を試みた。その結果、3 以上の回折データが収集可能な新たな晶形の結晶が得られた。その結晶の空間群は
以上の回折データが収集可能な新たな晶形の結晶が得られた。その結晶の空間群は 3
3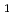 21(or its enantiomorph
21(or its enantiomorph  3
3 21)で、セル長は
21)で、セル長は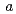 =
=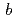 =134.8,
=134.8, 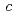 =105.7
=105.7 であった。
であった。
 1 chain and its interaction with its ligand
1 chain and its interaction with its ligand黒木 良太; 本庄 栄二郎; 玉田 太郎; 有馬 和彦*; 出原 賢治*
no journal, ,
インターロイキン-13は、IL-13受容体a1鎖(IL-13Ra1)及びIL-4受容体a鎖(IL-4Ra)という2つの受容体と相互作用し、そのシグナルを伝達する。われわれは既にIL-13Ra1のイムノグロブリン様ドメインが、IL-13の認識に重要であることを見いだしている。その相互作用様式を立体構造的に明らかにするため、IL-13Ra1及びIL-4Raの二つの受容体の細胞外領域をコードする遺伝子を抗体のFc領域の遺伝子に融合させ、さらにカイコ蛾による発現システムを用いて生産した。発現された蛋白質をProtein Gカラムを用いて精製した後、Fc領域をプロテアーゼ消化によって除去、さらに陰イオン交換クロマトグラフィーにより精製した。こうして得られたIL-13Ra1及びIL-4RaとリガンドであるIL-13との相互作用をゲル濾過を用いて解析した。その結果、IL-13は単独でIL-4Raと強く結合するが、IL-13Ra1との相互作用は弱いことがわかった。しかしながらIL-13Ra1及びIL-4Rの両方が存在するときには、IL-13の親和性は著しく向上し、3つの分子が複合体を形成することがわかった。
新村 信雄*; 田中 伊知朗*; 大西 裕季*; Ostermann, A.*; 栗原 和男; 本庄 栄二郎; 黒木 良太; 二見 淳一郎*; 山田 秀徳*
no journal, ,
本研究の目的は、中性子回折データを用いて厳密な数学的手法だけでタンパク質分子構造を決定する新しい方法を開発し、幾つかのタンパク質に適用してこれを実証することにある。この手法では、水素原子を特異的に重水素原子に置き換えた結晶を利用する。本研究は、各々特徴のある中性子関連研究を行ってきている日・仏・米3か国の研究グループによる共同研究(筆頭提案者: H. A. Hauptman/Hauptman研(米))である。日本グループ(共同提案者:新村信雄/茨城大学)では主としてタンパク質の結晶化と中性子回折実験を担当し、高分解能で精度の高い中性子回折データの取得を目指す。当初は研究対象を基本的なタンパク質(ミオグロビン,インスリン,RNase Aなど)に限定する。後に、仏グループ(共同提案者: A. Podjarny/IGBMC)から提供される重水素置換タンパク質(ルブレドキシン,アルドース還元酵素など)も対象に加える。これらの中性子回折実験データを用い米グループが解析を行う。当会議では、上記の方針に則った日本グループ側の研究計画を説明,議論する。
黒木 良太; 安達 基泰; 本庄 栄二郎; 栗原 和男; 大原 高志; 玉田 太郎
no journal, ,
中性子回折法で蛋白質の立体構造を解析すれば、タンパク質を取り巻く水和水の構造や水素結合・アミノ酸の解離状態など興味深い情報が得られる。しかしながら中性子結晶解析は、中性子を用いて得られる回折強度がX線と比べてはるかに弱いため、回折データ収集に2mm 以上の大きさの結晶を必要とすることや、データ収集に極めて長い時間がかかることから、構造生物学研究への寄与は限定的であった。しかしながら、この状況は次第に変わりつつある。その一つは2008年稼働予定の大型陽子加速器施設(J-PARC)である。J-PARCには新型の中性子回折計が設置予定であり、この装置の稼働によって回折データ収集に要する時間はこれまでの研究用原子炉と比べて約1/50となることが試算されている(2か月
以上の大きさの結晶を必要とすることや、データ収集に極めて長い時間がかかることから、構造生物学研究への寄与は限定的であった。しかしながら、この状況は次第に変わりつつある。その一つは2008年稼働予定の大型陽子加速器施設(J-PARC)である。J-PARCには新型の中性子回折計が設置予定であり、この装置の稼働によって回折データ収集に要する時間はこれまでの研究用原子炉と比べて約1/50となることが試算されている(2か月 2日)。ただ、上記の測定効率を達成するためには、依然として「結晶の大型化」が大きな問題として残っている。われわれはこの解決のために、従来の結晶化相図作成やマクロシーディング法に加えて「結晶格子工学:結晶中の分子接触面へのパッキング促進変異導入」による大型結晶作成や完全重水素化試料の調製法の確立も併せて実施している。本発表では中性子構造生物学の現状とより高度な利用を目的としたわれわれの取り組みについて紹介する。
2日)。ただ、上記の測定効率を達成するためには、依然として「結晶の大型化」が大きな問題として残っている。われわれはこの解決のために、従来の結晶化相図作成やマクロシーディング法に加えて「結晶格子工学:結晶中の分子接触面へのパッキング促進変異導入」による大型結晶作成や完全重水素化試料の調製法の確立も併せて実施している。本発表では中性子構造生物学の現状とより高度な利用を目的としたわれわれの取り組みについて紹介する。
黒木 良太; 玉田 太郎; 本庄 栄二郎; 前田 宜丈*
no journal, ,
生体内において、ある種のリガンドは受容体と呼ばれる蛋白質と結合することによって、細胞内で生ずるさまざまな反応の引き金になることが知られている。したがってリガンドはそれ自身が医薬品となる可能性があり、受容体はさまざまな薬物の標的分子として創薬研究の対象となる。受容体に関するさまざまな計測例として、ここでは顆粒球コロニー刺激因子(GCSF)によるその受容体(GCSF-R)活性化機構の研究について紹介する。GCSFはすでに上市され医薬品として用いられている分子であるが、GCSF-Rとの会合様式にはさまざまな説があった。そこでGCSFとGCSFRの会合様式を明らかにするために、水溶液中でリガンドと受容体の相互作用を計測した。まずGCSFとGCSFRの相互作用を滴定型熱量計で分析すると見かけ上1つの平衡反応(KD 10-9)しか検出されなかった。これはGCSFとGCSFRが1:1の複合体を形成することを示唆する。さらにこの複合体の水溶液中での平均分子量を光散乱分析によって測定すると約13万となった。この分子量はGCSFとGCSFRが2:2で会合した複合体を形成することを示唆する。ここで観測された複合体をX線結晶構造解析した結果、GCSFとGCSFRが2:2の複合体を形成することが確認でき、さらに複合体形成に関与する領域を特定することができた。受容体などの会合様式を少量で簡便に計測できる方法があれば、人工的なリガンド(医薬品)の開発に一層弾みがつくと期待できる。
玉田 太郎; 本庄 栄二郎; 新井 栄揮; 黒木 良太
no journal, ,
タンパク質の立体構造情報が集積される一方で、受容体のような膜タンパク質の構造情報は遅れがちである。細胞の表層に発現する受容体は、創薬における重要な標的であることが知られるが、その多くは一般的に不安定でプロテアーゼ消化されやすく、付加した糖鎖による不均一性から、構造解析の対象となりにくかった。そこでわれわれはこれらのタンパク質を効果的に結晶化させるため、抗体、特にFabフラグメントとの共結晶化研究を行っている。抗体を用いる結晶化では、膜タンパク質だけではなく他の結晶化しにくいタンパク質に対しても応用可能であるため、関連する技術やノウハウの集積はタンパク3000プロジェクトの目標と合致する。また、抗体自身を種々の産業用途に用いることができるため、産業応用面においても重要な研究である。これまでに目的タンパク質を結晶化するための抗体としてマウスやヒト由来の抗体を用いた結晶化研究を行っている。結晶化用抗体として、IgGやFabあるいはscFv等が考えられるが、われわれの検討結果から結晶化にはFabを用いることが最適であると判断した。本発表では立体構造認識抗体の取得法,IgGからFabの確実な調製法,Fab複合体の結晶化条件の特徴,Fabを用いた新規タンパク質の結晶化事例などを紹介する。
本庄 栄二郎
no journal, ,
タンパク質の結晶構造解析を促進するうえで、解析装置や結晶化技術の向上と同時に試料であるタンパク質を大量・安定に調製する技術も極めて重要である。われわれは難結晶化試料を結晶化しやすい性質に改変する試みも実施中である。本講演では、タンパク質試料の高度な調製法をわかりやすく概説する。併せて実際に構造解析に成功した試料の調製についても紹介する。
黒木 良太; 本庄 栄二郎; 前田 宜丈*; 玉田 太郎
no journal, ,
われわれは、ヒト顆粒球コロニー刺激因子(GCSF)受容体において、イムノグロブリン様ドメインとサイトカイン相同性領域からなるリガンド結合領域の立体構造をGCSFとの複合体として、2.8A分解能のX線結晶構造解析に成功した。GCSF受容体リガンド複合体の立体構造は、2分子のGCSFが2分子の受容体分子を橋渡しするように結晶学的な2回対称軸を形成していた。この構造は先に解析されたマウス受容体とヒトリガンドの複合体とは異なる構造であった。われわれが解析に成功した立体構造は、これまでに実施された受容体へのアミノ酸置換の結果をうまく説明できるとともに、近年解析されたヒトインターロイキン-6(IL-6)リガンド・受容体複合体の立体構造の一部とよく一致していた。これらの結果からわれわれが観測した構造は、GCSF受容体の活性型構造であると結論できる。
本庄 栄二郎; 玉田 太郎; 黒木 良太
no journal, ,
JSP-1(JNk Stimulatory Phosphatase-1)は同じタンパク質上のリン酸化されたセリンもしくはスレオニンの脱リン酸化を行う二重特異性チロシンホスファターゼの一つである。JSP-1はJNkを活性化することから、炎症反応やアポトーシスなどを抑制するターゲット分子として着目されている。JSP-1(C末端欠損体)の、6つのへリックス及び5つの ストランドからなる構造はすでに1.5
ストランドからなる構造はすでに1.5 分解能で明らかにされている。われわれはJSP-1(C末端欠損体)の水分子を含む水和構造を明らかにするためJSP-1の中性子構造解析に向けた完全重水素化JSP-1の試料調製を行っている。JSP-1をコードするDNAをpZWG-SP6PBベクター(ゾイジーン社)に挿入した後、SP6 RNAポリメラーゼでmRNAの合成を行った。JSP-1は小麦胚芽抽出液(ゾイジーン社)及び完全重水素化アミノ酸及びJSP-1 mRNAを用いた透析法(26
分解能で明らかにされている。われわれはJSP-1(C末端欠損体)の水分子を含む水和構造を明らかにするためJSP-1の中性子構造解析に向けた完全重水素化JSP-1の試料調製を行っている。JSP-1をコードするDNAをpZWG-SP6PBベクター(ゾイジーン社)に挿入した後、SP6 RNAポリメラーゼでmRNAの合成を行った。JSP-1は小麦胚芽抽出液(ゾイジーン社)及び完全重水素化アミノ酸及びJSP-1 mRNAを用いた透析法(26 C, 24h)で合成を行った。合成反応は非ラベル化アミノ酸を用いた場合とほぼ同じ効率であり、合成液1mlあたり0.4mgの完全重水素化JSP-1の合成ができた。現在、重水素化JSP-1試料について大型結晶の作成を行っている。
C, 24h)で合成を行った。合成反応は非ラベル化アミノ酸を用いた場合とほぼ同じ効率であり、合成液1mlあたり0.4mgの完全重水素化JSP-1の合成ができた。現在、重水素化JSP-1試料について大型結晶の作成を行っている。
本庄 栄二郎
no journal, ,
タンパク質のX線結晶構造解析を行ううえで結晶化という作業はもはやルーチン化,自動化され、その労力は大きく軽減されつつある。しかしながら、結晶性や結晶成長方向を人為的にコントロールする手段は未だ確立されておらず、難結晶性タンパク質の結晶化や中性子構造解析に不可欠な結晶の大型化の手段は試行錯誤の部分が多い。一般的に結晶中のタンパク質分子は隣り合う分子と相互作用し、規則正しくパッキングされていることから、この分子間接触面を人為的に改変することによりタンパク質の結晶性が大きく変化する可能性が考えられる。このような観点から現在われわれは、タンパク質分子表面の活性に関与しないアミノ酸残基を置換し、結晶性や結晶成長方向、さらには結晶の安定性を改変することを試みている。本研究会ではRNase1, Acidic FGF及びT4ファージリゾチームで行った例について紹介する。