Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
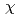 for brittle fracture in ductile-brittle transition temperature region
for brittle fracture in ductile-brittle transition temperature region北条 公伸*; 廣田 貴俊*; 名越 康人*; 深堀 拓也*; 清水 万真*; 下平 昌樹; 小川 琢矢*; 八代醍 健志*; 大畑 充*; 南 二三吉*
Proceedings of ASME 2024 Pressure Vessels & Piping Conference (PVP 2024) (Internet), 9 Pages, 2024/07
加圧熱衝撃事象における延性-脆性遷移温度域の原子炉圧力容器の破壊挙動を予測するため、日本溶接協会規格(WES)として塑性拘束補正係数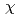 を導入した評価手法の策定を目指している。WESでは当該評価手法として、簡易法と詳細法の2種類を定める予定である。簡易法による塑性拘束補正係数
を導入した評価手法の策定を目指している。WESでは当該評価手法として、簡易法と詳細法の2種類を定める予定である。簡易法による塑性拘束補正係数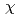 の算出では、材料の降伏応力、降伏比、ワイブル形状母数をパラメータとした式を用いる。また、塑性拘束補正係数
の算出では、材料の降伏応力、降伏比、ワイブル形状母数をパラメータとした式を用いる。また、塑性拘束補正係数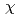 は評価対象の欠陥寸法や構造物の板厚にも依存する。本研究では、様々な原子炉圧力容器を対象として簡易法による塑性拘束補正係数
は評価対象の欠陥寸法や構造物の板厚にも依存する。本研究では、様々な原子炉圧力容器を対象として簡易法による塑性拘束補正係数 を求めるため、構造物の板厚や亀裂寸法、降伏比やワイブル形状母数を変化させた感度解析を実施した。また、加圧熱衝撃事象は温度変化を伴う事象であることから、ワイブル形状母数等の温度依存性に関する検討も行った。
を求めるため、構造物の板厚や亀裂寸法、降伏比やワイブル形状母数を変化させた感度解析を実施した。また、加圧熱衝撃事象は温度変化を伴う事象であることから、ワイブル形状母数等の温度依存性に関する検討も行った。
普天間 章; 眞田 幸尚; 石崎 梓; 川崎 義晴*; 岩井 毅行*; 平賀 祥吾*; 佐藤 一彦*; 萩野谷 仁*; 松永 祐樹*; 菊池 陽*; et al.
JAEA-Technology 2021-029, 132 Pages, 2022/02
2011年3月11日に発生した東北地方太平洋沖地震による津波に起因した東京電力福島第一原子力発電所事故によって、大量の放射性物質が周辺環境に飛散した。事故直後より、放射線の分布を迅速かつ広範囲に測定する手法として、航空機等を用いた空からの測定方法が適用されている。日本原子力研究開発機構では、有人ヘリコプターを使用した航空機モニタリングを福島第一原子力発電所周辺において継続的に実施してきた。本報告書では、令和2年度に実施した福島第一原子力発電所周辺におけるモニタリング結果について取りまとめると共に、過去のモニタリング結果から空間線量率等の変化量を評価し、変化量に寄与する要因について考察した。また、航空機モニタリングによる空間線量率の計算精度向上に資するために、航空機モニタリングデータを用いて地形の起伏を考慮に入れた解析を行った。地形の起伏を考慮に入れる前後での解析結果を比較し、本手法による精度向上効果を評価した。さらに、空気中のラドン子孫核種の弁別手法を測定結果に適用して、空気中のラドン子孫核種が航空機モニタリングに与える影響について評価した。
 radionuclide therapy
radionuclide therapy小川 数馬*; 水野 覚瑛*; 鷲山 幸信*; 柴 和弘*; 高橋 成人*; 小阪 孝史*; 渡辺 茂樹; 篠原 厚*; 小谷 明*
Nuclear Medicine and Biology, 42(11), p.875 - 879, 2015/11
被引用回数:27 パーセンタイル:72.67(Radiology, Nuclear Medicine & Medical Imaging)Sigma receptors are overexpressed in a variety of human tumors, making them potential targets for radionuclide receptor therapy. We have previously synthesized and evaluated 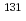 I-labeled (+)-2-[4-(4-iodophenyl)piperidino]cyclohexanol [(+)-[
I-labeled (+)-2-[4-(4-iodophenyl)piperidino]cyclohexanol [(+)-[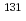 I]pIV], which has a high affinity for sigma receptors. Therefore, (+)-[
I]pIV], which has a high affinity for sigma receptors. Therefore, (+)-[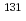 I]pIV significantly inhibited tumor cell proliferation in tumor-bearing mice. In the present study, we report the synthesis and the in vitro and in vivo characterization of (+)-[
I]pIV significantly inhibited tumor cell proliferation in tumor-bearing mice. In the present study, we report the synthesis and the in vitro and in vivo characterization of (+)-[ At]pAtV, an
At]pAtV, an  At-labeled sigma receptor ligand, that has potential use in
At-labeled sigma receptor ligand, that has potential use in  -radionuclide receptor therapy. The lipophilicity of (+)-[
-radionuclide receptor therapy. The lipophilicity of (+)-[ At]pAtV was similar to that of (+)-[
At]pAtV was similar to that of (+)-[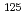 I]-pIV. Uptake of DU-145, prostate cancer cell lines, and the biodistribution patterns in DU-145 tumor-bearing mice at 1 h post-injection were also similar between (+)-[
I]-pIV. Uptake of DU-145, prostate cancer cell lines, and the biodistribution patterns in DU-145 tumor-bearing mice at 1 h post-injection were also similar between (+)-[ At]pAtV and (+)-[
At]pAtV and (+)-[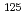 I]-pIV. Namely, (+)-[
I]-pIV. Namely, (+)-[ At]pAtV demonstrated high uptake and retention in tumor via binding to sigma receptors.
At]pAtV demonstrated high uptake and retention in tumor via binding to sigma receptors.
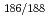 Re-labeled antibody (A7) for radioimmunotherapy with rhenium(I) tricarbonyl core as a chelate site
Re-labeled antibody (A7) for radioimmunotherapy with rhenium(I) tricarbonyl core as a chelate site小川 数馬*; 河嶋 秀和*; 絹谷 清剛*; 柴 和弘*; 小野口 昌久*; 木村 寛之*; 橋本 和幸; 小谷 明*; 佐治 英郎*
Annals of Nuclear Medicine, 23(10), p.843 - 848, 2009/12
被引用回数:10 パーセンタイル:32.81(Radiology, Nuclear Medicine & Medical Imaging)レニウム-186及び188は、がんの放射免疫療法に適した物理的性質を有する核種であるにもかかわらず、臨床への応用は十分に検討されていない。これは、抗体(高分子)に標識する方法が複雑であることが問題点としてあげられる。そこで、われわれは、簡便な標識法として、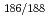 Re(I)トリカルボニル錯体とモノクローナル抗体(A7)を直接反応させる方法を検討した。その結果、2時間の反応で、収率23%及び28%で
Re(I)トリカルボニル錯体とモノクローナル抗体(A7)を直接反応させる方法を検討した。その結果、2時間の反応で、収率23%及び28%で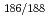 Re標識抗体が合成できることを確認した。また、精製直後の放射化学的純度は95%以上であった。次に、本
Re標識抗体が合成できることを確認した。また、精製直後の放射化学的純度は95%以上であった。次に、本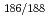 Re標識抗体を腫瘍モデルマウスへ投与した結果、投与24時間後において、腫瘍へ集積(13.1, 13.2% Dose/g)すること及び選択的集積性の指標となる腫瘍と血中の放射能濃度比が2以上であることが観察された。以上、レニウムトリカルボニル錯体により抗体(A7)が簡便に標識可能であること、標識体である
Re標識抗体を腫瘍モデルマウスへ投与した結果、投与24時間後において、腫瘍へ集積(13.1, 13.2% Dose/g)すること及び選択的集積性の指標となる腫瘍と血中の放射能濃度比が2以上であることが観察された。以上、レニウムトリカルボニル錯体により抗体(A7)が簡便に標識可能であること、標識体である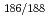 Re(CO)
Re(CO)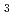 -A7は高い安定性を有し、担癌モデル動物において腫瘍への選択的な集積を示すことを明らかにした。今後は、収率を増加させるための標識法の改良が必要である。
-A7は高い安定性を有し、担癌モデル動物において腫瘍への選択的な集積を示すことを明らかにした。今後は、収率を増加させるための標識法の改良が必要である。
 Re-MAG3-conjugated bisphosphonate (
Re-MAG3-conjugated bisphosphonate ( Re-MAG3-HBP), an agent for treatment of painful bone metastases
Re-MAG3-HBP), an agent for treatment of painful bone metastases小川 数馬*; 向 高弘*; 川井 恵一*; 高村 徳人*; 花岡 宏史*; 橋本 和幸; 柴 和弘*; 森 厚文*; 佐治 英郎*
European Journal of Nuclear Medicine and Molecular Imaging, 36(1), p.115 - 121, 2009/01
被引用回数:25 パーセンタイル:59.11(Radiology, Nuclear Medicine & Medical Imaging)癌性骨転移疼痛緩和に有用であるビスホスホネート骨格に安定な Re錯体を導入した
Re錯体を導入した Re-MAG3-HBPを開発してきた。一方、本薬剤の錯体形成部位MAG3と
Re-MAG3-HBPを開発してきた。一方、本薬剤の錯体形成部位MAG3と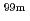 Tcとの錯体
Tcとの錯体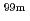 Tc-MAG3は、血清蛋白結合性が高く、蛋白結合阻害剤の併用により、血液及び非標的臓器からのクリアランスの促進に有効であることが示されており、本薬剤においても、同様な効果が期待される。そこで、本研究では、
Tc-MAG3は、血清蛋白結合性が高く、蛋白結合阻害剤の併用により、血液及び非標的臓器からのクリアランスの促進に有効であることが示されており、本薬剤においても、同様な効果が期待される。そこで、本研究では、 Re-MAG3-HBPの血液及び非標的臓器からのクリアランスの促進を目的に、本標識薬剤における蛋白結合阻害剤の影響を検討した。その結果、セフトリアキソンの併用により
Re-MAG3-HBPの血液及び非標的臓器からのクリアランスの促進を目的に、本標識薬剤における蛋白結合阻害剤の影響を検討した。その結果、セフトリアキソンの併用により Re-MAG3-HBPのラット血清,人血清及び人血清アルブミン中での蛋白結合率は大きく減少した。さらに、
Re-MAG3-HBPのラット血清,人血清及び人血清アルブミン中での蛋白結合率は大きく減少した。さらに、 Re-MAG3-HBPのラット体内動態におけるセフトリアキソン併用の影響を検討したところ、骨への集積性を損なうことなく、血液及び非標的臓器である肝臓,腎臓からのクリアランスが促進された。これらの結果は、蛋白結合阻害剤が、血清蛋白質と高い親和性を有する
Re-MAG3-HBPのラット体内動態におけるセフトリアキソン併用の影響を検討したところ、骨への集積性を損なうことなく、血液及び非標的臓器である肝臓,腎臓からのクリアランスが促進された。これらの結果は、蛋白結合阻害剤が、血清蛋白質と高い親和性を有する Re-MAG3-HBPの薬物動態を改善するのに有用であることを示している。
Re-MAG3-HBPの薬物動態を改善するのに有用であることを示している。
 Re-complex-conjugated bisphosphonate for the palliation of metastatic bone pain in an animal model
Re-complex-conjugated bisphosphonate for the palliation of metastatic bone pain in an animal model小川 数馬*; 向 高弘*; 浅野 大悟*; 河嶋 秀和*; 絹谷 清剛*; 柴 和弘*; 橋本 和幸; 森 厚文*; 佐治 英郎*
Journal of Nuclear Medicine, 48(1), p.122 - 127, 2007/01
転移性骨腫瘍の疼痛緩和を目的とした薬剤として、高い安定性を示す Re-MAG3錯体結合ビスホスホネート(
Re-MAG3錯体結合ビスホスホネート( Re-MAG3-HBP)を開発した。この化合物は、従来から検討されている
Re-MAG3-HBP)を開発した。この化合物は、従来から検討されている Re-HEDPに比べて、正常マウスにおいて、骨指向性薬剤として優れた体内分布を示した。
Re-HEDPに比べて、正常マウスにおいて、骨指向性薬剤として優れた体内分布を示した。 Re-MAG3-HBPの治療効果を骨転移モデル動物を用いて評価した。治療効果と副作用を評価するために、腫瘍の大きさと末梢血球数を計測し、骨痛の疼痛緩和は、機械刺激を加えるテスト法により評価した。その結果、
Re-MAG3-HBPの治療効果を骨転移モデル動物を用いて評価した。治療効果と副作用を評価するために、腫瘍の大きさと末梢血球数を計測し、骨痛の疼痛緩和は、機械刺激を加えるテスト法により評価した。その結果、 Re-HEDP投与群においては、腫瘍の大きさは未治療群と同等であった。それに対して、
Re-HEDP投与群においては、腫瘍の大きさは未治療群と同等であった。それに対して、 Re-MAG3-HBP投与群においては、有意に腫瘍増殖は抑制された。さらに、骨転移によって生じる痛みは、
Re-MAG3-HBP投与群においては、有意に腫瘍増殖は抑制された。さらに、骨転移によって生じる痛みは、 Re-MAG3-HBP又は
Re-MAG3-HBP又は Re -HEDPの投与により減弱した。しかも、その効果は、
Re -HEDPの投与により減弱した。しかも、その効果は、 Re-MAG3-HBP投与群の方が強い傾向を示した。これら結果は、
Re-MAG3-HBP投与群の方が強い傾向を示した。これら結果は、 Re-MAG3-HBPが転移性骨腫瘍の疼痛緩和薬剤として有用である可能性を示唆するものである。
Re-MAG3-HBPが転移性骨腫瘍の疼痛緩和薬剤として有用である可能性を示唆するものである。
 Re chelate-conjugated bisphosphonate for the development of new radiopharmaceuticals for bones
Re chelate-conjugated bisphosphonate for the development of new radiopharmaceuticals for bones上原 知也*; Jin, Z. L.*; 小川 数馬*; 秋澤 宏行*; 橋本 和幸; 中山 守雄*; 荒野 泰*
Nuclear Medicine and Biology, 34(1), p.79 - 87, 2007/01
被引用回数:27 パーセンタイル:60.21(Radiology, Nuclear Medicine & Medical Imaging) Reとビスホスホネートの一つであるHEDPとが形成する
Reとビスホスホネートの一つであるHEDPとが形成する Re-HEDP多核錯体は、癌性骨転移の疼痛緩和剤として、その臨床応用が期待されている。しかしながら、血液からの消失速度が遅いため、骨髄被曝が危惧されている。そのため、速やかな血液クリアランスを示す
Re-HEDP多核錯体は、癌性骨転移の疼痛緩和剤として、その臨床応用が期待されている。しかしながら、血液からの消失速度が遅いため、骨髄被曝が危惧されている。そのため、速やかな血液クリアランスを示す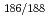 Re標識薬剤の開発が望まれている。そこで、ビスホスホネート部位(APD)に安定な放射性レニウム錯体([
Re標識薬剤の開発が望まれている。そこで、ビスホスホネート部位(APD)に安定な放射性レニウム錯体([ Re]CpTR-Gly)を結合させた薬剤として、[
Re]CpTR-Gly)を結合させた薬剤として、[ Re]CpTR-Gly-APDを設計・合成し、そのマウス体内動態を
Re]CpTR-Gly-APDを設計・合成し、そのマウス体内動態を Re-HEDPと比較検討し、その有用性を評価した。まず、生体内で非常に安定であることが確認された。また、マウス体内動態の実験から、[
Re-HEDPと比較検討し、その有用性を評価した。まず、生体内で非常に安定であることが確認された。また、マウス体内動態の実験から、[ Re]CpTR-Gly-APDは
Re]CpTR-Gly-APDは Re-HEDPに比べて骨への有意に高い集積を示す一方で、血液から速やかな放射能消失を示した。さらに、
Re-HEDPに比べて骨への有意に高い集積を示す一方で、血液から速やかな放射能消失を示した。さらに、 Re-HEDPで観察された胃への放射能集積は観察されなかった。以上の結果は[
Re-HEDPで観察された胃への放射能集積は観察されなかった。以上の結果は[ Re]CpTR-Gly-APDの設計の有用性を示すものであり、生体内で安定かつ血漿タンパク質との結合が少なく、さらに低濃度の配位子による標識が可能な二官能性キレート構造をビスホスホネートと結合させることにより、より有用な薬剤の開発が可能となると考えられる。
Re]CpTR-Gly-APDの設計の有用性を示すものであり、生体内で安定かつ血漿タンパク質との結合が少なく、さらに低濃度の配位子による標識が可能な二官能性キレート構造をビスホスホネートと結合させることにより、より有用な薬剤の開発が可能となると考えられる。
小川 数馬*; 向 高弘*; 荒野 泰*; 大高 章*; 上田 真史*; 上原 知也*; 間賀田 泰寛*; 橋本 和幸; 佐治 英郎*
Nuclear Medicine and Biology, 33(4), p.513 - 520, 2006/05
被引用回数:57 パーセンタイル:80.60(Radiology, Nuclear Medicine & Medical Imaging)患者のQOL(生活の質)の向上を目指した癌性骨転移の疼痛緩和薬剤の開発を目指して、二官能性放射性薬剤の概念に基づき、安定な Re化合物である
Re化合物である Re-MAMA(モノアミンモノアミドジチオール)を骨への集積能を有するビスホスホネート骨格を持つ化合物に導入した新規薬剤を合成し、その特性を調べた。ビスホスホネートの中央炭素に水酸基を有した
Re-MAMA(モノアミンモノアミドジチオール)を骨への集積能を有するビスホスホネート骨格を持つ化合物に導入した新規薬剤を合成し、その特性を調べた。ビスホスホネートの中央炭素に水酸基を有した Re-MAMA-HBPと、水酸基を持たない
Re-MAMA-HBPと、水酸基を持たない Re-MAMA-BPを合成し、骨の主成分であるハイドロキシアパタイトへの結合親和性及びマウス体内分布を比較検討した。レニウム-186標識MAMA結合ビスホスホネートは、レニウムの還元剤として塩化スズを用い、クエン酸中で
Re-MAMA-BPを合成し、骨の主成分であるハイドロキシアパタイトへの結合親和性及びマウス体内分布を比較検討した。レニウム-186標識MAMA結合ビスホスホネートは、レニウムの還元剤として塩化スズを用い、クエン酸中で ReO
ReO
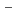 とMAMA結合ビスホスホネートを反応させ、逆相HPLCによる精製後、95%以上の放射化学的純度で得られた。
とMAMA結合ビスホスホネートを反応させ、逆相HPLCによる精製後、95%以上の放射化学的純度で得られた。 Re-MAMA-HBPは、
Re-MAMA-HBPは、 Re-MAMA-BPと比べ、インビトロにおいて、より高いハイドロキシアパタイトへの結合親和性を示し、インビボにおいて、より高い大腿骨への放射能集積を示した。したがって、
Re-MAMA-BPと比べ、インビトロにおいて、より高いハイドロキシアパタイトへの結合親和性を示し、インビボにおいて、より高い大腿骨への放射能集積を示した。したがって、 Re標識ビスホスホネートへの水酸基の導入は、骨集積増加に効果的であると考えられる。これらの結果は、骨指向性放射性治療薬剤のドラッグデザインに有用な指針を示すものである。
Re標識ビスホスホネートへの水酸基の導入は、骨集積増加に効果的であると考えられる。これらの結果は、骨指向性放射性治療薬剤のドラッグデザインに有用な指針を示すものである。
小川 数馬*; 向 高弘*; 荒野 泰*; 小野 正博*; 花岡 宏史*; 石野 誠悟*; 橋本 和幸; 西村 洋*; 佐治 英郎*
Bioconjugate Chemistry, 16(4), p.751 - 757, 2005/07
被引用回数:64 パーセンタイル:87.36(Biochemical Research Methods)患者のQOL(生活の質)の向上を目指した癌性骨転移の疼痛緩和薬剤として、ビスホスホネート化合物の一つであるHEDPに 線を放出する
線を放出する Reを標識した
Reを標識した Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への高い集積などが問題となっている。これはおもに、
Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への高い集積などが問題となっている。これはおもに、 Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、二官能性放射性医薬品の概念に基づき、安定な
Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、二官能性放射性医薬品の概念に基づき、安定な Re単核錯体である
Re単核錯体である Re-MAG3(メルカプトアセチルトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤
Re-MAG3(メルカプトアセチルトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤 Re-MAG3-HBPを設計・合成し、その特性を調べた。その結果、MAG3-HBPと
Re-MAG3-HBPを設計・合成し、その特性を調べた。その結果、MAG3-HBPと Re標識クエン酸の配位子置換反応により、
Re標識クエン酸の配位子置換反応により、 Re-MAG3-HBPを95%以上の放射化学的純度で合成できた。また、本化合物は、リン酸緩衝溶液において、24時間後でも分解は観察されず、
Re-MAG3-HBPを95%以上の放射化学的純度で合成できた。また、本化合物は、リン酸緩衝溶液において、24時間後でも分解は観察されず、 Re-HEDPに比べてかなり安定であった。さらに、動物実験の結果、
Re-HEDPに比べてかなり安定であった。さらに、動物実験の結果、 Re-MAG3-HBPは、
Re-MAG3-HBPは、 Re-HEDPに比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることが明らかになった。
Re-HEDPに比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることが明らかになった。
小川 数馬*; 向 高弘*; 荒野 泰*; 花岡 宏史*; 橋本 和幸; 西村 洋*; 佐治 英郎*
Journal of Labelled Compounds and Radiopharmaceuticals, 47(11), p.753 - 761, 2004/11
被引用回数:31 パーセンタイル:64.04(Biochemical Research Methods)癌性骨転移の疼痛緩和薬剤として、ビスホスホネート化合物の一つであるHEDPに 線を放出する
線を放出する Reを標識した
Reを標識した Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への集積などが問題となっている。これはおもに、
Re-HEDP化合物が検討されているが、血液クリアランスの遅さや胃への集積などが問題となっている。これはおもに、 Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、安定な
Re-HEDPが多核錯体であり、体内で不安定であるためであると考えられている。そこで、本研究では、安定な Re単核錯体である
Re単核錯体である Re-MAMA(モノアミンモノアミドジチオール)をビスホスホネート骨格を持つ化合物に導入した新規薬剤
Re-MAMA(モノアミンモノアミドジチオール)をビスホスホネート骨格を持つ化合物に導入した新規薬剤 Re-MAMA-BPを設計・合成し、その化学的挙動を調べた。その結果、
Re-MAMA-BPを設計・合成し、その化学的挙動を調べた。その結果、 Re標識グルコヘプトン酸の配位子置換反応により、
Re標識グルコヘプトン酸の配位子置換反応により、 Re-MAMA-BPを標識率32.0
Re-MAMA-BPを標識率32.0 4.1%で合成することができた。また、本化合物は、緩衝液中(pH7.0)では、
4.1%で合成することができた。また、本化合物は、緩衝液中(pH7.0)では、 Re-HEDPに比べてかなり安定であった。したがって、
Re-HEDPに比べてかなり安定であった。したがって、 Re-MAMA-BPは、癌性骨転移の疼痛緩和薬剤として優れた化学的特性を有していることが明らかになった。
Re-MAMA-BPは、癌性骨転移の疼痛緩和薬剤として優れた化学的特性を有していることが明らかになった。
向 高弘*; 小川 数馬*; 荒野 泰*; 小野 正博*; 藤岡 泰*; 出雲 三四六; 小西 淳二*; 佐治 英郎*
Journal of Labelled Compounds and Radiopharmaceuticals, 44(Suppl.1), p.S617 - S618, 2001/05
腫瘍骨転移の疼痛緩和薬剤として、 Re-HEDPが検討されているが、
Re-HEDPが検討されているが、 Re錯体の安定性が悪く、血液クリアランスの遅延、胃への集積が問題となっている。そこで本研究では、分子内にビスホスホネート構造と独立して安定な
Re錯体の安定性が悪く、血液クリアランスの遅延、胃への集積が問題となっている。そこで本研究では、分子内にビスホスホネート構造と独立して安定な Re単核錯体を導入した新規薬剤の開発を計画し、MAMA-APBを設計した。合成した
Re単核錯体を導入した新規薬剤の開発を計画し、MAMA-APBを設計した。合成した Re-MAMA-APBを緩衝液中でインキュベートしたところ、
Re-MAMA-APBを緩衝液中でインキュベートしたところ、 Re-HEDPに比べて安定であることが明らかとなった。また、
Re-HEDPに比べて安定であることが明らかとなった。また、 Re-MAMA-APBをマウスに投与したところ、胃への放射能集積を示すことなく、骨への高い集積性と速やかな血液から消失を示し、その結果、骨と血液との放射能集積比を大きく向上した。以上の結果は、骨を標的とする放射性薬剤の開発に有用な知見を与えるものと考えられる。
Re-MAMA-APBをマウスに投与したところ、胃への放射能集積を示すことなく、骨への高い集積性と速やかな血液から消失を示し、その結果、骨と血液との放射能集積比を大きく向上した。以上の結果は、骨を標的とする放射性薬剤の開発に有用な知見を与えるものと考えられる。
小川 数馬*; 小野 正博*; 藤岡 泰*; 佐治 英郎*; 向 高弘*; 小西 淳二*; 上原 知也*; 荒野 泰*; 小野間 克行
核医学, 37(5), P. 577, 2000/09
 Reとbisphosphonate(BP)のひとつであるHEDPとの多核錯体である
Reとbisphosphonate(BP)のひとつであるHEDPとの多核錯体である Re-HEDPは、癌性骨転移の疼痛緩和薬剤として期待されているが、生体内での安定性が乏しいことが問題である。そこで生体内で安定な
Re-HEDPは、癌性骨転移の疼痛緩和薬剤として期待されているが、生体内での安定性が乏しいことが問題である。そこで生体内で安定な Re標識骨疼痛緩和剤の開発を目的として、BPの炭素側鎖に
Re標識骨疼痛緩和剤の開発を目的として、BPの炭素側鎖に Reと安定な錯体を形成する部位を結合した化合物を設計した。目的とする化合物は総収率2.7%で合成された。
Reと安定な錯体を形成する部位を結合した化合物を設計した。目的とする化合物は総収率2.7%で合成された。 Re標識は、
Re標識は、 Re標識glucoheptonateとの配位子交換反応により行い、放射化学的純度は95%以上であった。なお、本標識化合物の体内動態については、現在検討をすすめている最中である。
Re標識glucoheptonateとの配位子交換反応により行い、放射化学的純度は95%以上であった。なお、本標識化合物の体内動態については、現在検討をすすめている最中である。
 Re)標識ビオチンの作製
Re)標識ビオチンの作製平沢 真*; 河嶋 秀和*; 小川 数馬*; 木村 寛之*; 小野 正博*; 橋本 和幸; 佐治 英郎*
no journal, ,
放射免疫療法では、抗体の血中クリアランスが遅いため、放射能の腫瘍血液比が低くなり、放射線感受性の高い骨髄の被曝量が増すことが問題となっている。そこで、ビオチン-ストレプトアビジン(SA)の特異的結合システムを用いたプレターゲティングの概念による新規RI-DDS治療薬剤の開発を目指し、放射性レニウムをSA化抗体へ効率的に導入するため、 Reトリカルボニル錯体によるヒスチジン化ビオチン(His-biotin)の標識を試みた。
Reトリカルボニル錯体によるヒスチジン化ビオチン(His-biotin)の標識を試みた。 Re-His-biotinは放射化学的収率7.1%、純度90%以上で合成できた。次に、得られた
Re-His-biotinは放射化学的収率7.1%、純度90%以上で合成できた。次に、得られた Re-His-biotinのマウス血漿中での安定性を評価するとともに、SAへの結合性を測定した結果、本標識体は37
Re-His-biotinのマウス血漿中での安定性を評価するとともに、SAへの結合性を測定した結果、本標識体は37 Cの血漿中において、24時間経過後も95%以上が未変化体として存在し、安定であった。また、SAに
Cの血漿中において、24時間経過後も95%以上が未変化体として存在し、安定であった。また、SAに Re-His-biotinを添加したところ、85.4%がSAと結合し、この結合はビオチンを共存させることで98%が阻害された。以上の結果、
Re-His-biotinを添加したところ、85.4%がSAと結合し、この結合はビオチンを共存させることで98%が阻害された。以上の結果、 Re-His-biotinはSA化抗体の標識試薬として有用であることが示唆された。本研究は、文部科学省原子力基礎基盤戦略研究イニシアティブ「先進的ながん診断・治療を実現するRI-DDS開発研究」の成果である。
Re-His-biotinはSA化抗体の標識試薬として有用であることが示唆された。本研究は、文部科学省原子力基礎基盤戦略研究イニシアティブ「先進的ながん診断・治療を実現するRI-DDS開発研究」の成果である。
 Re-labeled bisphosphonate in a rat model of bone metastasis
Re-labeled bisphosphonate in a rat model of bone metastasis小川 数馬*; 向 高弘*; 浅野 大悟*; 河嶋 秀和*; 橋本 和幸; 柴 和弘*; 森 厚文*; 佐治 英郎*
no journal, ,
われわれは、患者のQOL(生活の質)の向上を目指した癌性骨転移の疼痛緩和薬剤として、二官能性放射性医薬品の概念に基づき、安定な Re単核錯体である
Re単核錯体である Re-MAG3(メルカプトトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤
Re-MAG3(メルカプトトリグリシン)をビスホスホネート骨格を持つ化合物に導入した新規薬剤 Re-MAG3-HBPを開発し、その特性を調べてきた。本化合物は、従来から検討されている
Re-MAG3-HBPを開発し、その特性を調べてきた。本化合物は、従来から検討されている Re-HEDP(ビスホスホネートの一種)に比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることがわかった。さらに、骨転移がんモデルのラットを用いた実験から、本化合物は、疼痛緩和効果を示すこと及び
Re-HEDP(ビスホスホネートの一種)に比べて、高い骨への集積,速い血中クリアランス及び低い胃への集積を示し、癌性骨転移の疼痛緩和薬剤として優れた特性を有していることがわかった。さらに、骨転移がんモデルのラットを用いた実験から、本化合物は、疼痛緩和効果を示すこと及び Re-HEDPは、腫瘍の増殖を抑える効果は見られなかったのに対して、本化合物は、腫瘍増殖の抑制効果を示すことが明らかになった。以上の結果、
Re-HEDPは、腫瘍の増殖を抑える効果は見られなかったのに対して、本化合物は、腫瘍増殖の抑制効果を示すことが明らかになった。以上の結果、 Re-MAG3-HBPを用いた内部放射線治療は、骨転移がんモデルのラットにおいて有効であり、
Re-MAG3-HBPを用いた内部放射線治療は、骨転移がんモデルのラットにおいて有効であり、 Re-HEDPより優れていることを示した。
Re-HEDPより優れていることを示した。
小川 数馬*; 向 高弘*; 川井 恵一*; 高村 徳人*; 花岡 宏史*; 橋本 和幸; 佐治 英郎*
no journal, ,
癌性骨転移疼痛緩和薬剤には、高い骨集積性とともに、速やかな血液及び非標的臓器中からの消失(クリアランス)が、求められる。これまでに、ビスホスホネート骨格に安定な Re錯体を導入した
Re錯体を導入した Re-MAG3-HBPを開発し、その有用性を明らかにしてきた。一方、本薬剤の錯体形成部位MAG3と
Re-MAG3-HBPを開発し、その有用性を明らかにしてきた。一方、本薬剤の錯体形成部位MAG3と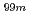 Tcとの錯体
Tcとの錯体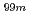 Tc-MAG3は、血清蛋白結合性が高く、蛋白結合阻害剤の併用により、血液及び非標的臓器からのクリアランスの促進に有効であることが示されている。そこで、本研究では、
Tc-MAG3は、血清蛋白結合性が高く、蛋白結合阻害剤の併用により、血液及び非標的臓器からのクリアランスの促進に有効であることが示されている。そこで、本研究では、 Re-MAG3-HBPの血液及び非標的臓器からのクリアランスの促進を目的に、本標識薬剤における蛋白結合阻害剤の影響を検討した。その結果、血清アルブミンに高親和性を示す薬物セフトリアキソンの併用により
Re-MAG3-HBPの血液及び非標的臓器からのクリアランスの促進を目的に、本標識薬剤における蛋白結合阻害剤の影響を検討した。その結果、血清アルブミンに高親和性を示す薬物セフトリアキソンの併用により Re-MAG3-HBPのインビトロにおける蛋白結合率は減少し、ラット体内動態においては、骨への集積性を損なうことなく、血液及び非標的臓器である肝臓,腎臓からのクリアランスが促進された。これらの結果は、蛋白結合阻害剤セフトリアキソンが、
Re-MAG3-HBPのインビトロにおける蛋白結合率は減少し、ラット体内動態においては、骨への集積性を損なうことなく、血液及び非標的臓器である肝臓,腎臓からのクリアランスが促進された。これらの結果は、蛋白結合阻害剤セフトリアキソンが、 Re-MAG3-HBP投与時の骨髄被曝等副作用の軽減に有用であることを示している。
Re-MAG3-HBP投与時の骨髄被曝等副作用の軽減に有用であることを示している。
 Re-labeled antibody (A7) by a simple method using rhenium(I) tricarbonyl complex
Re-labeled antibody (A7) by a simple method using rhenium(I) tricarbonyl complex小川 数馬*; 河嶋 秀和*; 絹谷 清剛*; 吉本 光喜*; 柴 和弘*; 木村 寛之*; 橋本 和幸; 森 厚文*; 佐治 英郎*
no journal, ,
 Reは、優れた核的性質に加え、ジェネレータ核種であるため、RI内部投与治療用として最も有用なRIの一つである。しかしながら、抗体等蛋白質に標識する方法が複雑であることが問題点としてあげられる。そこで、われわれは、簡便な標識法として、
Reは、優れた核的性質に加え、ジェネレータ核種であるため、RI内部投与治療用として最も有用なRIの一つである。しかしながら、抗体等蛋白質に標識する方法が複雑であることが問題点としてあげられる。そこで、われわれは、簡便な標識法として、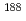 Re(I)トリカルボニル錯体とモノクローナル抗体(A7)を直接反応させる方法を検討した。その結果、2時間の反応で、収率27%で
Re(I)トリカルボニル錯体とモノクローナル抗体(A7)を直接反応させる方法を検討した。その結果、2時間の反応で、収率27%で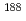 Re標識抗体が合成できることを確認した。また、精製直後の放射化学的純度は98%以上、24時間経過後も約93%が元の化学形を保っており、本
Re標識抗体が合成できることを確認した。また、精製直後の放射化学的純度は98%以上、24時間経過後も約93%が元の化学形を保っており、本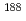 Re標識抗体が安定であることが認められた。さらに、本
Re標識抗体が安定であることが認められた。さらに、本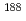 Re標識抗体を腫瘍モデルマウスへ投与した結果、投与24時間後において、腫瘍へ集積(11.2% Dose/g)すること及び腫瘍と血中の放射能濃度比が1以上であることが観察された。今後は、収率を増加させるための標識法の改良が必要である。
Re標識抗体を腫瘍モデルマウスへ投与した結果、投与24時間後において、腫瘍へ集積(11.2% Dose/g)すること及び腫瘍と血中の放射能濃度比が1以上であることが観察された。今後は、収率を増加させるための標識法の改良が必要である。
安江 健一*; 平松 良浩*; 小川 智史*; 山崎 伶士*; 廣瀬 健大朗*; 三浦 知督*; 白濱 吉起*; 杉戸 信彦*; 向吉 秀樹*; 藤田 奈津子; et al.
no journal, ,
令和6年能登半島地震に伴い、珠洲市若山町を流れる若山川に沿って部分的に2mを超える断層崖が生じた。この崖の一部は、既存の崖地形と重なることから、崖をつくる断層が過去に繰り返し活動していた可能性がある。我々は、この崖の成因と過去にも同じような活動があったかどうかを明らかにするために、断層崖を横切るトレンチ掘削調査を実施した。また、令和6年9月能登半島豪雨により若山川が氾濫し、その際の侵食によって断層露頭が出現したことから、その露頭の観察も実施した。本結果から、一部の断層はシルト岩の層理面に沿った剪断によって形成されたと考えられ、その変位は今回の地震だけでなく、過去にも同じ場所で変位していた可能性が高く、過去約700年の間に少なくとも2回の変位があったと考えられることが分かった。